Состав жесткой воды | РусВатер
Словосочетание «жесткая вода» знакомо многим, но не все до конца понимают, что оно означает. Как правило, таким термином характеризуют водопроводную воду, содержащую повышенное количество солей кальция и магния. Состав жесткой воды в каждом отдельном случае разный, даже в одном городе могут быть районы, в которых этот показатель отличается.

В рамках данной терминологии также различаются понятия жесткости воды, которая может быть как временной, так и постоянной.
Временная жесткость определяется наличием в воде из-под крана карбонатов и гидрокарбонатов. Для распада таких соединений воду достаточно прокипятить – соли элементов осядут на стенках посуды как накипь.
Постоянная жесткость характеризуется наличием в воде кальциевых и магниевых солей, которые образуют химсоединения с сильными кислотами. Такие примеси не выводятся кипячением, для их устранения требуются более действенные средства.
Почему вода бывает жесткой?
Перед тем, как попасть к вам в квартиру или дом, вода проходит немалый путь. В природе она выполняет функцию растворителя: Mg и Ca появляются в ней после прохождения через известняк, глину и иные породы. В результате вода получает разную степень жесткости, для отражения которой существует система единиц, позволяющая ее измерять.

В соответствии с российскими стандартами за единицу измерения в такой системе принимается моль/м3 воды. Единого мнения о том, какую воду считать жесткой, а какую – нет, не существует. Усредненные данные варьируются в следующих пределах:
- Для очень мягкой воды коэффициент принимает значения от 0 вплоть до 1,5.
- Мягкая вода дает показатели от 1,5 до 3.
- Жидкость умеренной жесткости попадает в интервал от 3 до 6.
- Жесткая вода находится в промежутке от 6 до 9.
- У очень жесткой воды коэффициент превышает порог в 12.
Характеристика жесткой воды
К числу параметров, позволяющих установить степень жесткости воды, также можно отнести определение уровня ее кислотности. Такой показатель, как pH жесткой воды, находится выше отметки в 8,5. Для здоровья такая вода не представляет опасности, однако способна привести к появлению эстетических проблем. Жесткая вода, pH которой превышает установленные нормы, дает устойчивый щелочной привкус, после ее кипячения на посуде и бытовой технике оседает накипь, она снижает эффективность применения моющих средств при стирке и гигиенических процедурах.
Формула жесткой воды, как правило, содержит повышенное количество кальция, что для человека может быть даже полезным, особенно при недостатке данного элемента в организме. Однако у здоровых людей постоянное употребление такой воды может стать причиной появления камней в почках.
В быту жесткая вода имеет следующие свойства:
- Образование пленок и осадка при добавлении мыла.
- Ухудшение свойства тканей при стирке.
- Повышение расхода моющих средств.
- Использование жесткой воды для приготовления пищи влияет на вкус продуктов, замедляет их термическую обработку.
- В паровых котлах и бойлерах такая вода оседает в виде накипи на нагревательных элементах, что становится причиной их перегрева и поломки.
Таким образом, для устранения проблемы жесткости в воде необходимо использовать современные системы для ее умягчения. Подобрать подходящий вариант установки, позволяющий привести воду в доме к нужным параметрам мягкости, помогут специалисты нашей компании. Для правильного подбора проводится анализ, в ходе которого выясняется химический состав жесткой воды.
Как еще можно снизить жесткость воды в доме или квартире?
Многочисленные опыты и тесты, проведенные с жидкостью повышенной жесткости, не смогли установить среди ее параметров признаки, представляющие опасность для здоровья людей. Вкусовые качества воды – понятие субъективное, однако специалисты не рекомендуют употреблять жесткую воду в значительных объемах. Решить проблему и добиться умягчения воды помогут современные фильтры.
Модификации таких установок могут быть различными – ионообменными, катионными, обратного осмоса. Убрать соли жесткости из воды помогает и электрический ток, однако такая обработка невозможна без применения оборудования особого вида. Уменьшить концентрацию ненужных солей помогает дистилляция, а также применение реагентных способов. Последние предполагают ввод специальных веществ, вступающих в реакцию с кальциевыми и магниевыми солями. После образования нерастворимых соединений они просто выпадают как осадок. Такими реагентами выступают кальцинированная сода и гашеная известь, упрощенный вариант борьбы с жесткостью – кипячение.
Умягчение воды
«Жесткая» вода
Для многих применений жесткость воды не играет существенной роли (например, для тушения пожаров, полива огорода, уборки улиц и тротуаров). Но в ряде случаев жесткость может создать проблемы. При принятии ванны, мытье посуды, стирке, мытье машины жесткая вода гораздо менее эффективна, чем мягкая. И вот почему:
При использовании мягкой воды расходуется в 2 раза меньше моющих средств;
Жесткая вода, взаимодействуя с мылом, образует «мыльные шлаки», которые не смываются водой и оставляют малосимпатичные разводы на посуде и поверхности сантехники; «Мыльные шлаки» также не смываются с поверхности человеческой кожи, забивая поры и покрывая каждый волос на теле, что может стать причиной появления сыпи, раздражения, зуда;
При нагревании воды, содержащиеся в ней соли жесткости кристаллизуются, выпадая в виде накипи. Накипь является причиной 90% отказов водонагревательного оборудования. Поэтому к воде, подвергаемой нагреву в котлах, бойлерах и т.п., предъявляются на порядок более строгие требования по жесткости;
Во многих промышленных процессах соли жесткости могут вступить в химическую реакцию, образовав нежелательные промежуточные продукты.
Понятие жесткости
Жесткость
воды принято связывать с катионами
кальция (Са
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются
Катионы | Анионы |
Кальций (Ca2+) | Гидрокарбонат (HCO3-) |
Магний (Mg2+) | Сульфат (SO42-) |
Стронций (Sr2+) | Хлорид (Cl-) |
Железо (Fe2+) | Нитрат (NO3-) |
Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Виды жесткости
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Единицы измерения
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3).
Один моль на кубический метр соответствует массовой концентрации эквивалентов ионов кальция (1/2 Ca2+) 20.04 г/м3 и ионов магния (1/2Mg2+) 12.153 г/м3. Числовое значение жесткости, выраженное в молях на кубический метр равно числовому значению жесткости, выраженному в миллиграмм-эквивалентах на литр (или кубический дециметр), т.е. 1моль/м3=1ммоль/л=1мг-экв/л=1мг-экв/дм3.
Кроме этого в зарубежных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm CaCO3.
Соотношение этих единиц жесткости представлено в следующей таблице:
Единицы жесткости воды | ||||
Моль/м3(мг-экв/л) | Немецкий градус, do | Французский градус, fo | Американский градус | ppm мг/дм3 СаСО3 |
1.000 | 2.804 | 5.005 | 50.050 | 50.050 |
Примечание: Один немецкий градус соответствует 10 мг/дм3 СаО или 17.86 мг/дм3 СаСО3 в воде. Один французский градус соответствует 10 мг/дм3 СаСО3 в воде. Один американский градус соответствует 1 мг/дм3 СаСО3 в воде.
Происхождение жесткости
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50—60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3)
Влияние жесткости
С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете на мг-эквивалент) в диапазоне 2—6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже. В некоторых случаях для потребителей приемлема вода с жесткостью выше 10 мг-экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения
Всемирная Организация Здравоохранения не предлагает какой-либо рекомендуемой величины жесткости по показаниям влияния на здоровье. В материалах ВОЗ говорится о том, что хотя ряд исследований и выявил статистически обратную зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о причинном характере этой связи. Аналогичным образом, однозначно не доказано, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека
В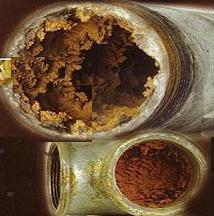 месте
с тем, в зависимости от рН и щелочности,
вода с жесткостью выше 4 мг-экв/л
может вызвать в распределительной
системе отложение шлаков и накипи
(карбоната кальция), особенно при
нагревании. Именно поэтому нормами
Котлонадзора вводятся очень жесткие
требования к величине жесткости
воды, используемой для питания котлов
(0.05—0.1 мг-экв/л).
месте
с тем, в зависимости от рН и щелочности,
вода с жесткостью выше 4 мг-экв/л
может вызвать в распределительной
системе отложение шлаков и накипи
(карбоната кальция), особенно при
нагревании. Именно поэтому нормами
Котлонадзора вводятся очень жесткие
требования к величине жесткости
воды, используемой для питания котлов
(0.05—0.1 мг-экв/л).
Кроме того, при взаимодействии солей жесткости с моющими веществами (мыло, стиральные порошки, шампуни) происходит образование «мыльных шлаков» в виде пены. Это приводит не только к значительному перерасходу моющих средств. Такая пена после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах (неприятное чувство «жестких» волос хорошо известное многим). Главным отрицательным воздействием этих шлаков на человека является то, что они разрушают естественную жировую пленку, которой всегда покрыта нормальная кожа и забивают ее поры. Признаком такого негативного воздействия является характерный «скрип» чисто вымытой кожи или волос. Оказывается, что вызывающее у некоторых раздражение чувство «мылкости» после пользования мягкой водой является признаком того, что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие кремы и прочие хитрости для восстановления той защиты кожи, которой нас и так снабдила матушка Природа.
Вместе с тем, необходимо упомянуть и о другой стороне медали. Мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость (щелочность) и может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений (особенно в теплотехнике) иногда приходится проводить специальную обработку воды с целью достижения оптимального соотношения между жесткостью воды и ее коррозионной активностью.
Под жесткостью воды понимают свойство, обусловленное присутствием в воде растворенных солей, в основном кальция и магния. Жесткость воды подразделяется па карбонатную (присутствие в ней гидрокарбонатов магния и кальция) и некарбонатную (наличие солей сильных кислот — хлоридов или сульфатов кальция и магния). Сумма карбонатной и некарбонатной жесткости определяет общую жесткость.
Карбонатную жесткость называют временной, так как при длительном кипячении подобной воды гидрокарбонаты разлагаются с образованием осадка карбоната кальция и выделением углекислого газа:
Ca(HCO3)2 = СаСО3+СO2↑ + Н2O
Mg(НСО3)2 = Mg(ОН)2↓ + 2СO2↑
Жесткость воды, обусловленная наличием сульфатов магния и кальция, называется постоянной. Она может быть устранена лишь химическим путем:
CaSO4+Na2CO3=CaCO3↓+Na2SO4.
В настоящее время для устранения жесткости используют также ионообменные смолы.
Способы устранения жесткости воды
В природной воде растворены соли кальция и магния. Это гидрокарбонаты и сульфаты. Покажем два способа осаждения гидрокарбонатов для уменьшения жесткости воды. Первый способ – кипячение. При кипячении* растворимые гидрокарбонаты переходят в нерастворимые карбонаты, и жесткость воды уменьшается.
Сa(HCO3)2 = CaCO3 ↓ + H2O + CO2↑
Второй способ – добавление известковой воды. При добавлении известковой воды гидрокарбонаты переходят в карбонаты и вода становится более мягкой.
Сa(HCO3)2+ Ca(OH)2 = CaCO3 ↓ +2 H2O
Но жесткость воды зависит еще и от сульфатов кальция и магния. Сульфаты кальция и магния можно удалить с помощью карбоната натрия. При добавлении карбоната натрия сульфаты переходят в нерастворимые карбонаты кальция и магния.
CaSO4 + Na2CO3= CaCO3 ↓+ Na2SO4
Устранение из воды солей жесткости, т. е. умягчение её, необходимо производить для питания котельных установок, причем жесткость воды для котлов среднего и низкого давления должна быть не более 0,3 мг-экв/л. Умягчать воду требуется также для таких производств, как текстильное, бумажное, химическое, где вода должна иметь жесткость не более 0,7 -1,0 мг-экв/л. Умягчение воды для хозяйственно-питьевых целей также целесообразно, особенно в случае, если она превышает 7мг-экв/л. Применяют следующие основные методы умягчения воды:
реагентный метод — путем введения реагентов, способствующих образованию малорастворимых соединений кальция и магния и выпадению их в осадок;
катионовый метод, при котором умягчаемая вода фильтруется через вещества, обладающие способностью обменивать содержащиеся в них катионы (натрия или водорода) на катионы кальция и магния, растворенный в воде солей. А результате обмена задерживаются ионы кальция и магния и образуются натриевые соли, не придающие воде жесткость;
термический метод, заключающийся в нагревании воды до температуры выше 100°, при этом почти полностью удаляются соли карбонатной жесткости.
Часто методы умягчения применяют комбинированно. Например, часть солей жесткости удаляют реагентным способом, а оставшуюся часть с помощью катионного обмена. Из реагентных методов содово-известковый способ умягчения является наиболее распространенным. Сущность его сводится к получению вместо растворенных в воде солей Са Mg нерастворимых солей СаСО3 и Mg(OH)2, выпадающих в осадок. Оба реагента — соду Na2CO3 и известь Са(ОН)2 — вводят в умягчаемую воду одновременно или поочередно. Соли карбонатной, временной жесткости удаляют известью, не карбонатной, постоянной жесткости — содой. Химические реакции при удалении карбонатной жесткости протекают следующим образом:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
Гидрат окиси магния Mg(OH)2 коагулирует и выпадает в осадок. Для устранения некарбонатной жесткости в умягчаемую воду вводят Na2CO3. Химические реакции при удалении некарбонатной жесткости следующие:
Na2CO3 + CaSO4 = CaCO3 + Na2SO4;
Na2CO3 + СаС12 = СаСО3 + 2NaCl.
В результате реакции получается углекислый кальций, который выпадает в осадок. Реагенты, применяемые при обработке воды, вводят в воду в следующих местах:
а) хлор (при предварительном хлорировании) — во всасывающие трубопроводы насосной станции первого подъема или в водоводы, подающие воду на станцию очистки;
б) коагулянт — в трубопровод перед смесителем или в смеситель;
в) известь для подщелачивания при коагулировании — одновременно с коагулянтом;
г) активированный уголь для удаления запахов и привкусов в воде до 5 мг/л — перед фильтрами. При больших дозах уголь следует вводить на насосной станции первого подъема или одновременно с коагулянтом в смеситель водоочистной станции, но не ранее чем через 10 мин после введения хлора;
д) хлор и аммиак для обеззараживания воды вводят до очистных сооружений и в фильтрованную воду. При наличии в воде фенолов аммиак следует вводить как при предварительном, так и при окончательном хлорировании.
К специальным видам очистки и обработки воды относятся опреснение, обессоливание, обезжелезивание, удаление из воды растворенных газов и стабилизация.
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Инженерное ремесло / / Жесткость воды. Умягчение воды. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды. Накипь — отложения в трубах и на стенках емкостей. / / Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды. Поделиться:
| |||||||||||||||||||
Жесткость воды что это такое
Жесткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворенных солей щелочноземельных металлов, главным образом, кальция и магния (так называемых «солей жесткости»). Вода – сложное природное вещество, в состав которого входит целый набор микроэлементов. В том или ином виде вода содержится во всех живых организмах. Что подразумевается под понятием жесткость, и что определяет данный показатель?
Подробнее про жесткость воды
Жесткость – это свойство воды, которое определяет ее потребительские качества и имеет важное хозяйственное значение. В процессе кипячения жесткая жидкость образует накипь на стенках и внутренних деталях нагревательных приборов, что вызывает ухудшение теплотехнических характеристик бытовой техники. Не особенно подходит она и для стирки, поскольку способствует снижению очищающих характеристик моющих средств и увеличивает их расход.
| Градусы dH | Характер воды | Жесткость в мг. х экв/л. | Эквивалент в mg/L |
| 23 — 34° | Очень жесткая | выше 12 мг х экв/л | 320 — 530 ppm |
| 13 — 22° | Жесткая | 8 – 12 мг х экв/л | 210 — 320 ppm |
| 9 — 12° | Средней жесткости | 4 – 8 мг х экв/л | 140 — 210 ppm |
| 5 — 8° | Мягкая | 1,5 – 4 мг х экв/л | 70 — 140 ppm |
| 0 — 4° | Очень мягкая | До 1,5 мг х экв/л | 0 — 70 ppm |
Откуда берется высокая жесткость? Ее определяет наличие солей магния и кальция – химических компонентов, выполняющих роль активных регуляторов различных химических процессов в окружающей среде. Естественно, что жидкость, которая берется из разных водоемов, может иметь ту или иную степень жесткости. При этом река, озеро и любой другой источник пополняются из подземных источников, протекающих в известняковых пластах. Проходя через них, вода обогащается солями жесткости, а значит, будет жесткой. Для сравнения – данный показатель у поверхностных вод всегда заметно ниже, чем у подземных. Жесткость воды в природных источниках постоянно изменяется. Максимальных отметок она достигает зимой, а минимальных – весной, во время таяния снегов.
Таким образом, жесткой является та вода, которая содержит соли магния и кальция в больших количествах. Кстати, магниевые соли растворяются хуже кальциевых, и жидкость с их высоким содержанием имеет выраженный горький вкус.
Шкала жесткости воды
Выделяются следующие виды жесткости:
- Общая – определяется как суммарная концентрация ионов магния и кальция.
- Карбонатная – зависит от наличия в воде карбонатов, гидрокарбонатов кальция и магния. Практически полностью устраняется в ходе кипячения, поэтому второе название карбонатной жесткости – временная. В процессе нагрева гидрокарбонаты распадаются – образуется угольная кислота, а карбонаты кальция, гидроксиды магния выпадают в виде осадка.
- Некарбонатная – обусловлена присутствием магниевых и кальциевых кислотных солей. При кипячении не устраняется (то есть является постоянной).
Общая жесткость измеряется в GH. GH показывает суммарное содержание щелочноземельных металлов в виде ионов. Для примера – в воде, значение GH которой близкое к нулю, аквариумные рыбки не живут, употреблять ее в пищевых целях также не рекомендуется.
В каких единицах измеряется жесткость
В мире для измерения показателей жесткости используются разные значения. В России Госстандарт установил следующий показатель – моль на кубический метр. Числовое значение жесткости, которое выражается в молях на кубический метр, равняется числовому значению жесткости в миллиграмм-эквивалентах на литр. На западе используют немецкий (d°, dH), французский (f°), американский (ppm CaCO3) градусы.
Как повысить и понизить жесткость воды в аквариуме. Определение временной, или карбонатной жесткости
Чтобы создать комфортные условия для жизни аквариумных рыбок, важно использовать воду оптимальной жесткости, с заданным кислотно-щелочным балансом. Чтобы повысить жесткость воды, используют известняк и мрамор. Чем мягче вода, тем быстрее она повысит жесткость. Другой способ – химический, с применением хлористого кальция и магнезии. Максимальный эффект достигается при использовании обоих препаратов одновременно.
Чтобы уменьшить жесткость, воду нужно прокипятить. Как долго это следует делать? Учтите, что для снижения жесткости вдвое, кипятить воду нужно минимум в течение получаса. Другой способ – вымораживание. Воду наливают в пластиковый контейнер и помещают в морозилку. Затем лед растапливают, а полученную воду используются в пищевых или любых других целях.
Если объемы воды большие, проще будет использовать специальное оборудование. Широкое распространение в быту в последние годы получили установки обратного осмоса. Для расчета необходимого объема водопроводной воды используйте формулу – вычитание объема воды, получаемой из водопровода, из объема с заданной жесткостью, который нужно получить.
Часто методы умягчения используют комбинированно. Например, одну часть солей жесткости убирают реагентным способом, а другую с помощью катионного обмена. Приведем формулы содово-известкового способа умягчения:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
В итоге Mg(OH)2 коагулирует, выпадая в осадок. Затем, в целях устранения некарбонатной жесткости, вводится Na2CO3. Последующие химические реакции:
Na2CO3 + CaSO4 = CaCO3 + Na2SO4 и Na2CO3 + СаС12 = СаСО3 + 2NaCl.
В итоге образуется углекислый кальций, выпадающий затем в осадок. Реагенты вводят в разные зоны:
- хлор – во всасывающие трубопроводы;
- коагулянт – в трубопровод перед смесителем либо непосредственно в смеситель;
- известь – вместе с коагулянтом;
- уголь активированный – перед фильтрами;
- хлор и аммиак – в фильтрованную воду.
Опреснение, обессоливание, удаление растворенных газов, железа, стабилизация – это специальные способы очистки. Так если для снижения жесткости используются методы катионирования или ионного обмена, речь идет об обессоливании. Вода, которая получается на выходе, не содержит ни анионов, ни катионов солей.
Как измерить жесткость
Для оценки показателей жесткости воды используются следующие способы:
- Комплексонометрическое титрование трилоном Б. Метод сложный и самый точный.
- Покупные тесты. Не на 100% точные, зато простые и недорогие.
- Измерение электропроводности. Используйте кондуктометр.
- С помощью ионометра и ионоселективных электродов.
- С применением методики титрования соляной кислотой проб воды. Сложный и не очень точный метод. То же самое можно сказать о тестах с применение хозяйственного мыла.
Под титрованием подразумевается добавление в воду реагента требуемой концентрации. Концентрация солей жесткости определяется в зависимости от реакции реагента с водой. Приготовить реактив просто – достаточно смешать кислоту с дистиллированной водой в заданных пропорциях. Готовый раствор опасности не представляет.
Проще всего использовать готовые тексты. Для этого 5 мл воды наливается в стаканчик, затем в жидкость по каплям добавляется содержимое теста, после каждой капли вода перемешивается. Делать так нужно до тех пор, пока цвет не станет зеленым вместо розового.
Влияние жесткости воды, нормативные требования и рекомендации
Какую воду можно употреблять для приготовления пищи и питья? Требования относительно жесткости жидкости зависят от условий конкретной местности. Учтите, что слишком жесткая вода имеет горький вкус и негативно влияет на работу органов пищеварения. ВОЗ конкретные цифры не называет, хотя исследований на тему связи качества воды с заболеваниями сердца, сосудов и других органов организма проводились неоднократно. Слишком мягкая вода – это тоже плохо, поскольку она нарушает водно-солевой баланс. Жидкость с жесткостью от 4 мг-экв/ чревата – главная причина образования накипи на внутренних деталях отопительных систем. Вредна она и для кожи, волос.
Вместо заключения
Жесткость – важный параметр воды, который зависит от количества и типа растворенных в ней минеральных веществ. Смягчение следует делать только после предварительного анализа. Почему? Потому что не все меды смягчения снижают содержание минеральных веществ – они могут просто превращать соли жесткости в соли, которые никак не влияют на рассматриваемый показатель.
Жесткость воды – единицы измерения и способы умягчения

 Обычная вода состоит не только из атомов водорода и кислорода, в ней так же присутствует большое количество различных примесей. Именно наличие примесей определяет жесткость воды, а единицы измерения (°Ж – градус жёсткости) показывает, насколько этот показатель превышает допустимые нормы.
Обычная вода состоит не только из атомов водорода и кислорода, в ней так же присутствует большое количество различных примесей. Именно наличие примесей определяет жесткость воды, а единицы измерения (°Ж – градус жёсткости) показывает, насколько этот показатель превышает допустимые нормы.Жёсткость воды требуется определять не только инженерам, которые занимаются прокладкой коммуникаций, но и обычной людям в быту. Если мы используем электрический чайник или стиральную машину с функцией нагрева воды, то все это может выйти из строя, если данный показатель будет слишком высок. Даже хорошо растворить мыло в такой воде у вас вряд ли получится.
О том, как определить уровень жесткости водопроводной воды, а также о методах борьбы с большим содержанием примесей будет подробно рассказано в данной статье.
Жёсткая и мягкая вода – в чём разница
На количество соли в воде влияет наличия растворённых в ней элементов кальция и магния. Значительно повысить этот показатель может также наличие гидрата железа, содержание которого в артезианских водах бывает избыточным.
В том случае, когда таких примесей содержится незначительное количество, её называют “мягкой”. Этот показатель обычно разделяется на 3 категории:
- Мягкая.
- Средняя.
- Жёсткая.

 Мягкая – это дождевая или полученная в результате перегонки жидкость. В такой воде практически отсутствуют минеральные примеси.
Мягкая – это дождевая или полученная в результате перегонки жидкость. В такой воде практически отсутствуют минеральные примеси.В большинстве случаев она может получиться и в результате длительного кипячения или добавления специальных химических реагентов.
Средняя – встречается наиболее часто в водопроводных системах, а также в родниковой и артезианской воде.
Жёсткая – к данной категории относится морская, океанская, а также вода вытекающая из пластов породы богатой минеральными отложениями. В ней может быть растворено большое количество солей. Если брать в процентном соотношении, то соленость может достигать до 33% от общего объема.
Рассмотрим разновидности жёсткости
Этот показатель принято разделять на следующие категории.
- Постоянная – является неизменным показателем, который зависит от содержания сульфатов и хлоридов.
- Временная – обусловлена содержанием бикарбонатов кальция и магния. Название этот вид жёсткости получил за способность практически полностью нейтрализоваться в результате кипячения.
- Жёсткость общая – получается в результате сложения показателей постоянной и временной.
Для того чтобы точно определить этот показатель, необходимо знать какими единицами измерения это можно сделать.
Единицы измерения жёсткости
Для правильного подсчёта уровня жёсткости необходимо определить концентрацию катионов кальция и магния. В настоящее время этот показатель определяется в следующих единицах измерения:
- Моль/м3 (моль на кубический метр) – применялся в России до 2014 г.
- °Ж (градус жёсткости) – данная единица измерения используется в России с 2014 г.
- dH (немецкий градус) – единица измерения используется в странах Европы.
- fo (французский градус) – также применяется в европейский странах.
- ppm CaCO3 (американский градус) – единица измерения используется в североамериканских штатах.
Следует отметить, что в нашей стране выражение общей жёсткости моль/м3 стало использоваться только с 1952 года. До этого времени расчёты осуществлялись в градусах, которые были равны современному немецкому градусу.
С 2014 года в России действует международный стандарт подсчёта жёсткости, который выражается в градусах (°Ж). Один градус равен 1/2 миллимоля на литр жидкости, поэтому подсчитать уровень концентрации вещества в жидкости не составит большого труда.
Причины появления жёсткости воды

 При круговороте воды в природе жидкость превращается в пар и поднимается в верхние слои атмосферы. После конденсации она выпадает в виде осадков и не содержит примесей влияющих на жёсткость, но проходя через слой земной коры, жидкость растворяет различные породы, в которых содержатся калий и магний. Насыщаясь этими элементами вода увеличивает свою жёсткость. В море она всегда жёсткая по причине большой концентрации хлорида натрия.
При круговороте воды в природе жидкость превращается в пар и поднимается в верхние слои атмосферы. После конденсации она выпадает в виде осадков и не содержит примесей влияющих на жёсткость, но проходя через слой земной коры, жидкость растворяет различные породы, в которых содержатся калий и магний. Насыщаясь этими элементами вода увеличивает свою жёсткость. В море она всегда жёсткая по причине большой концентрации хлорида натрия.При необходимости снизить концентрацию ионов калия и магния, можно применить различные методы уменьшения количества солевых примесей.
Методы устранения жёсткости
Для борьбы с чрезмерным содержанием солей применяются следующие методы:
- Кипячение – полностью устраняет временную жёсткость. Данный процесс сопровождается обильным выпадением осадка на дне и стенках резервуара, где происходит кипячение.


- Химическим путём – уменьшить количество солей можно с помощью гашённой извести. Если к извести будет добавлена сода, то можно избавиться и от постоянной жёсткости
- Заморозка – данный метод позволяет легко справиться с постоянной жёсткостью. Чтобы смягчить воду достаточно заморозить её до такого состояния, когда будет не более 10% воды, а 90% льда. Затем незамерзшая жидкость сливается, а вода в твёрдом состоянии растапливается и используется по назначению.
- Перегонка – все соли являются нелетучими веществами, поэтому достаточно воду сначала превратить в пар с помощью нагрева, а затем конденсировать.
- Электромагнитный способ – для смягчения жидкости используется электромагнитное поле. Данный способ уменьшения солей в воде применяется наиболее часто в котельных установках.
- Катионный обмен – высокоэффективный способ очистки воды от избыточного количество солей. Очищение происходит при пропускании воды через слой катионита.


Любой из предложенных способов умягчения воды позволяет справиться с высоким уровнем этого показателя, но для очистки от солей питьевой воды химический способ обычно не применяется.
Как влияет жёсткость на качество воды
Жёсткость питьевой воды влияет, прежде всего, на её вкусовые качества. Порог вкуса ионов кальция находящихся в питьевой воде составляет 2-6 мг-экв/л. Порог вкуса для ионов магния значительно ниже, поэтому самой приятной на вкус питьевой водой считается та, в которой этот показатель равен от 1,6 до 3 мг-экв/л.
В некоторых случаях вода с жёсткостью до 10 мг-экв/л может использоваться в качестве питьевой, но длительное её употребление может негативно влиять на здоровье человека. Слишком жёсткая вода нежелательна для применения в устройствах нагрева жидкости. Электрические чайники, бойлеры, стиральные и посудомоечные машины обязательно имеют в своей конструкции ТЭН, который в кратчайшие сроки “обрастает” отложениями, и процесс нагрева жидкости осуществляется менее эффективно.
Длительная эксплуатация электро нагревателя со значительным слоем накипи приводит к перегреву элемента и выходу его из строя. К счастью, для очистки от накипи достаточно растворить 2 пакетика лимонной кислоты в 1 литре воды и хорошо прокипятить чайник или любой другой водонагреватель. После чего следует тщательно промыть прибор и использовать его далее по назначению.
Смотреть видео
Негативно влияет высокое содержание солей воды и на процесс стирки. Растворение моющего вещества в воде богатой ионами калия и магния приводит к чрезмерному образованию пены. Пена способствует образованию налёта на элементах стиральной машины, который также может негативно влиять на работоспособность некоторых узлов этого бытового прибора.
Последствия для здоровья человека
При длительном употреблении жёсткой воды в организме человека наблюдаются серьёзные отклонения от нормы, которые прежде всего проявляются в работе следующих органов:
- Желудочно-кишечный тракт (ЖКТ) – при соединении солей входящих в состав жёсткой воды с животными жирами образуются соли жирных кислот, которые обволакивая стенки желудка и кишечника, препятствуя нормальной ферментации и значительно затормаживают перистальтику. В результате в организме накапливаются вредные вещества и шлаки, развивается дисбактериоз.
- Работа суставов – некоторые виды солей попадая в организм человека образуют неорганические вещества, которые со временем вытесняют синовиальную жидкость из суставов. В результате такого замещения происходит обрастание суставов кристаллами, которые вызывают сильную боль при движении. Длительное употребление жёсткой воды может привести к заболеванию артритом и полиартритом.
- Сердечно-сосудистая система – при значительном увеличении показателя жесткости питьевой воды, работа сердца ухудшается, вплоть до проявления выраженной аритмии.
- Состояние кожных покровов – жёсткая вода приводит к преждевременному старению кожи. Негативное воздействие наблюдается как при приёме жидкости внутрь, так и при мытье посуды. При контакте средства для мытья посуды с жёсткой водой образуется плёнка, которая при оседании на кожу долгое время оказывает негативное влияние на верхние слои эпидермиса.
- Образование камней в почках – данное утверждение является мифом, который развенчан благодаря работе учёных. Процесс камнеобразования не зависит от качества питьевой воды. Камни в почках образуются в основном из-за нехватки кальция в организме. В результате дефицита этого элемента происходит вымывание его из костей с оседанием в мочевыводящей системе.
Смотреть видео
Всех перечисленных недугов и болезненных состояний можно избежать, если использовать многоступенчатую фильтрацию воды. Применение таких устройств не будет стоить слишком дорого, а вот лечение различных патологий может обойтись в значительные суммы денег.
Методы определения жёсткости воды
Чтобы избежать негативного влияния на здоровье жёсткой воды, а также продлить срок эксплуатации нагревающим приборам, необходимо определить примерное количество солей калия и магния растворённых в жидкости. Сделать это на вкус довольно проблематично, ведь изменения могут быть выявлены таким способом только в случае превышения определённого значения.
Чтобы определить в домашних условиях большое содержание солей калия, магния и натрия можно воспользоваться следующими методами:
- Попытаться растворить мыло в воде, если пена не образуется, то вода очень жёсткая и употреблять её не следует.
- Если в чайнике и других приборах образуется большое количество накипи в течение небольшого промежутка времени, то вода, однозначно, превышает безопасные показатели этого значения.
- С помощью индикаторных полосок можно более точно определить количество солей в жидкости, но такой метод потребует небольших финансовых расходов. Для проведения опыта достаточно опустить индикаторную полоску в воду на несколько секунд, а через минуту сравнить её цвет с имеющейся в инструкции таблицей.
Смотреть видео
Заключение
Очень важно знать какой жёсткости вода используется для питья, а так же в котлах отопления и в других водонагревательных приборах. Необходимость применения точных единиц измерения для проведения вычислений в домашних условиях не всегда обязательно.
В химической промышленности и на других высокотехничных производствах, наоборот потребуется знать количество растворённых в воде солей до миллиграмма, поэтому можно использовать любые единицы измерения этого показателя, предложенные в данной статье, чтобы определить и, при необходимости, снизить количество солей в воде.
Смотреть видео
Жёсткость воды — это… Что такое Жёсткость воды?
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Жёсткая и мягкая вода
Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой. Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2), и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья,есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний. Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием солей жёсткости.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости используются градусы жёсткости и миллиграммы эквивалента на литр (мг-экв/л).
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими. В России для измерения жёсткости иногда использовалась нормальная концентрация ионов кальция и магния, выраженная в миллиграммах эквивалента на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
С 1 января 2005 года в России введен новый Национальный стандарт Российской Федерации ГОСТ Р 52029-2003 «Вода. Единица жесткости»[1]. По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля на литр (1 °Ж = 1 мг-экв/л).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Градус | Обозначение | Определение | Величина | |
|---|---|---|---|---|
| °Ж | ммоль/л | |||
| Немецкий | °dH (degrees of hardness), °dGH (German (Deutsche) Hardness), °dKH (для карбонатной жёсткости) | 1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды | 0,3566 | 0,1783 |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | 0,2848 | 0.1424 |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | 0,1998 | 0,0999 |
| Американский | ppm | 1 часть CaCO3 на 1 000 000 частей воды | 0,0200 | 0,0100 |
По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж).
Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка (например, жёсткость волжской воды в марте — 4,3 °Ж, в мае — 0,5 °Ж [2]). В подземных водах жёсткость обычно выше (до 80-100 °Ж) и меньше изменяется в течение года.
Методы устранения
Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
- 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
- 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Полностью очистить воду от солей жёсткости можно дистилляцией.
См. также
- Кислые соли
- Щелочи
- Сульфаты
- Хлораты
Ссылки
Примечания
Глава 7. Жесткость природных вод.
О составе природных вод. Природная вода содержит в качестве примесей различные неорганические и органические соединения, находящиеся в растворенном и коллоидном состоянии. Условно разделяют содержащиеся в природной воде вещества на пять групп:
1. Главнейшие ионы. Из числа катионов в природной воде в наибольшем количестве встречаются :Na+ Ca2+ , Mg2+ , K+; из анионов: HCO3– , SO42– , Cl–,. Другие катионы Fe2+, Fe3+, Mn2+ и анионы (HSiO3–, SO32–, S2O32– встречаются значительно реже.
2. Микроэлементы. К ним относятся такие, содержание которых в воде составляет менее 10-3 %. Микроэлементами, влияющими на качество воды, являются бром, йод, фтор, медь, кобальт, никель и некоторые другие.
3. Растворенные газы. В воде чаще всего растворены газы: СО2, О2, N2, H2S, CH4 и другие.
4. Биогенные вещества. К ним относятся те соединения, которые возникают в связи с жизнедеятельностью организмов. В их состав часто входят различные формы азота (аммиачный, нитритный, нитратный), фосфора. кремния, железа.
5. Органические вещества. Органическое вещество природных вод представлено различного рода растительными и животными организмами, микроорганизмами и продуктами их взаимодействия с окружающей средой.
Минерализация природной воды, т.е. общее содержание в ней солей, может меняться в широких пределах в зависимости от источника. Содержание различных ионов в воде также зависит от источника. Минерализация речной воды составляет от 200 до 1000 мг/л. Минерализация озер колеблется в пределах 15–300 мг/л (меньше на севере, больше на юге). Морская вода обладает значительно большей концентрацией солей. Среднюю соленость вод океанов можно считать близкой 35 г/л.
Общая минерализация учитывается при техническом использовании воды, поскольку влияет на корродирующее действие воды по отношению к металлам, бетону и некоторым природным каменным материалам. Однако, оказалось, что гораздо большее значение имеет жесткость воды.
Жесткость воды – совокупность свойств природных вод, обусловленная наличием в них растворенных солей кальция и магния.
Свойства жесткой воды:
1. Вода, содержащая значительные количества солей кальция и магния, непригодна для многих технических целей так как образует на стенках паровых котлов и других поверхностях накипь: плотную корку серого или черного цвета, состоящую в основном из СаСО3, Мg(ОН)2 с примесью ионов железа, меди и др. Наличие накипи резко снижает теплопередачу, что приводит к перерасходу топлива.
2. Ионы Са2+ и Mg2+ безопасны в санитарно-гигиеническом отношении, но их высокое содержание в воде приводит к увеличению времени приготовления пищи, ухудшению ее вкуса (чай, овощи), соли кальция и магния, выпадающие при кипячении жесткой воды, обуславливают сухость и раздражение кожи.
3. Жесткая вода не образует пены с мылом, т.к. содержащиеся в нем натриевые соли органических кислот переходят в нерастворимые кальциевые соли:
2RCOONa + Са2+ = Ca(RCOO)2 + Na+
Источники жесткости.
Ионы Са2+ и Mg2+ появляются в природных водах в результате взаимодействия воды с известняком (СaCO3), доломитoм (СaCO3·MgCO3) и гипсом (CaSO4·2H2O). Растворение известняка происходит при наличии в воде углекислого газа, при этом карбонат кальция переходит в гидрокарбонат:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Преобладание ионов Са2+ над ионами Mg2+ обычно присуще мало и среднеминерализованным водам. Соотношение Са2+/Mg2+ = 24. При увеличении минерализации до 500-1000 мг/л это соотношение равно 1, а в водах океанов ионы магния в значительной степени преобладают.
Единицы жесткости.
Жесткость воды – Ж(B) выражают количеством миллимолей эквивалентов (Z=2) ионов Са2+ и Mg2+, содержащихся в 1 л.
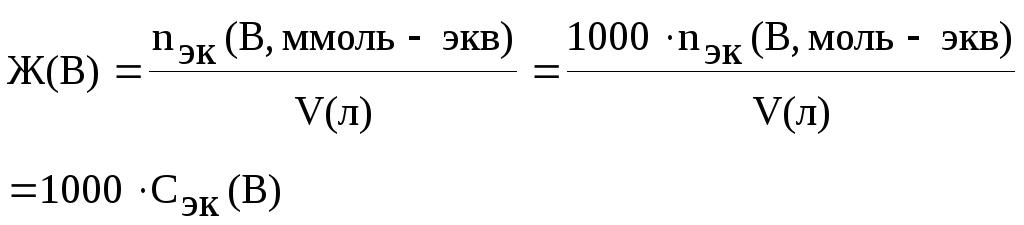
1 ммоль-экв соответствует содержанию в 1 л воды 20,04 мг ионов Са2+ или 12,16 мг ионов Mg2+.
В зависимости от величины общей жесткости (Жо) — суммарного содержания ионов Са2+ и Mg2+природные воды делятся на следующие группы:
– мягкие — до 2 ммоль-экв/л;
– средней жесткости — 2-10 ммоль-экв/л;
– жесткие — более 10 ммоль-экв/л.
Общая жесткость вод Черного моря составляет 65,5 ммоль-экв/л, вод мирового океана — 138,5 ммоль-экв/л (Са2+ = 22,5 и Mg2+ = 108 ммоль-экв/л, соответственно). В реке Обь в районе г.Новосибирска общая жесткость равна 3,8 ммоль-экв/л. Наиболее мягкая вода — дождевая, жесткость которой составляет от 0,07 до 0,1 ммоль-экв/л.
Жесткость воды ухудшает ее технические характеристики, поэтому ее необходимо устранять. Процесс устранения (снижения) жесткости воды называется умягчением воды.
По отношению к процессам умягчения воды различают жесткость карбонатную и некарбонатную .
Карбонатная жесткость обусловлена наличием в воде гидрокарбонатов кальция и магния: Ca(HCO3)2 и Mg(HCO3)2.
Некарбонатная жесткость вызвана присутствием в воде других солей кальция и магния, например хлоридов и сульфатов.
М
 етоды
умягчения воды.
етоды
умягчения воды.
