Умягчение воды — процесс, в результате которого из воды удаляются соли жесткости. Умягчение сегодня может осуществляться с использованием ряда способов. Это может быть:
- Умягчение с реагентами
- Умягчение ионным обменом
- Умягчение нанофильтрацией
Каждый из способов не универсален и может быть применён в тех или иных случаях. Как правило, для умягчения используется система фильтров, каждый из которых направлен на удаление примесей того или иного типа (крупных взвесей и т.д.).
В нашем ассортименте представлен широкий спектр оборудования для осуществления такой процедуры, как умягчение. Всё оборудование прошло тестирование и имеет высокое качество. Вы можете использовать его длительный период времени. В выборе, установке и планировании систем Вы всегда сможете воспользоваться помощью специалистов.
Процесс удаления из воды солей жесткости называют умягчением.
Жесткая питьевая вода горьковата на вкус и оказывает отрицательное влияние на органы пищеварения. По нормам ВОЗ оптимальная жесткость питьевой воды составляет 1,0-2,0 мг-экв/л. В бытовых условиях избыток солей жесткости приводит к зарастанию нагревающихся поверхностей в бойлерах, чайниках, трубах, отложению солей на сантехарматуре и выводу ее из строя, а также оставляет налет на волосах и коже человека, создавая неприятное ощущение их «жесткости». При стирке, взаимодействуя с ПАВами мыла или стиральных порошков, соли жесткости связывают их и требуют большего расхода.
В пищевой промышленности жесткая вода ухудшает качество продуктов, вызывая выпадение солей при хранении. Это характерно для бутилированной питьевой воды, пива, соков, водки. Даже при мытье бутылок она оставляет несмываемые потеки. Поэтому жесткость воды, используемой для приготовления различных продуктов, четко регламентирована и находится на уровне 0,1-0,2 мг-экв/л.
В энергетике случайное кратковременное попадание жесткой воды с систему очень быстро выводит из строя теплообменное оборудование, трубопроводы. Даже небольшой слой отложений солей на поверхности теплообменного оборудования приводит к резкому снижению коэффициента теплопередачи и увеличению расхода топлива. Трубопроводы зарастают настолько, что их производительность падает в несколько раз. Поэтому в тех процессах, где допустимо использование воды с некоторым содержанием солей, ее жесткость ограничивается еще меньшими значениями — 0,03-0,05 мг-экв/л.
Процессы извлечения из воды солей Са2+ и Mg2+ в водоподготовке называют умягчением. Относительно селективное удаление солей жесткости может производиться 3 методами:
- реагентным умягчением;
- ионным обменом;
- нанофильтрацией.
Кроме того, для защиты нагревательных элементов водонагревательного оборудования применяют магнитные преобразователи воды, которые на химический состав воды не влияют и не снижают ее жесткость. Они лишь предотвращают отложение солей жесткости на нагревательные элементы оборудования.
Реагентное умягчение воды.
Многие соли жесткости имеют низкую растворимость. При введении в раствор некоторых реагентов увеличивается концентрация анионов, которые образуют малорастворимые соли с ионами жесткости Са2+ и Mg2+. Такой процесс называют реагентным умягчением.
Различают умягчение известкованием и содо-известкованием.
При известковании в раствор добавляют гашеную известь Са(ОН)2 до рН около 10. В результате протекают реакции:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О;
Mg(HCО3)2 + 2Са(ОН)2 = Mg(OH)2 + 2CaCО3 + 2Н2О.
Данный способ используют при высокой карбонатной и низкой некарбонатной жесткости, когда требуется одновременное снижение жесткости и щелочности. Остаточная жесткость на 0,4-0,8 мг-экв/л превышает некарбонатную жесткость. Обычно используется совместно с ионообменным умягчением.
При содо-известковании в раствор добавляют гашеную известь Са(ОН)2 и соду Na2C03 до рН около 10. В результате протекают реакции:
Са(НСО3)2 + Са(ОН)2 + Na2CО3 = 2CaCО3i+ 2NaOH + H2CО3;
Mg(HCО3)2 + 2NaOH = Mg(OH)2 + 2NaHCО3.
Как следует из уравнений реакций, в процессе образования и осаждения осадка из раствора извлекаются соли жесткости. Вместе с ними удаляются коллоидные и взвешенные частицы с ассоциированными на них загрязнениями. На хлопьях осадка частично сорбируются органические загрязнения.
При содо-известковании за счет избытка ионов НСО3— достигается большая полнота извлечения солей жесткости. Повышение температуры до 70-80°С позволяет довести остаточную жесткость до 0,35-1,0 мг-экв/л. Того же результата можно достигнуть увеличением доз реагентов.
Процессы осаждения осуществляются в отстойниках и осветлителях со взвешенным слоем осадка.
Отстойники малопроизводительны, и получаемая в них гидроксидная пульпа имеет высокую влажность — 91-99%. Поэтому они в настоящее время практически не применяются.
В практике используются различные варианты осветлителей со взвешенным слоем осадка. В них очищаемый раствор подается снизу и проходит через слой осадка. Это увеличивает коэффициент очистки. Для уменьшения объема шлама используются дополнительные зоны и камеры шламоуплотнения. Увеличение степени осветления достигается введением дополнительных секций тонкослойного отстаивания.
Реагентные методы в подготовке питьевой воды не используются. После них вода имеет сильнощелочную реакцию. Они широко применяются в энергетике и промышленности как первая ступень очистки до механических фильтров. При совместной работе они позволяют умягчить воду, удалить взвешенные вещества, включая коллоиды, и частично очистить ее от органических веществ.
Поскольку осаждение образовавшихся хлопьев происходит очень медленно, производительность оборудования низкая и оно имеет большие габариты. В результате образуются отходы в виде трудно утилизируемых шламов. Процесс требует тщательного контроля, причем в основном ручного, поскольку зависит от многих факторов: температуры воды, точности дозировки реагентов, исходной мутности и т. п.
Новые технологические решения (тонкослойное отстаивание, контактная коагуляция, ввод флокулянтов) позволяют достигнуть тех же показателей при меньших расходе реагентов, размерах установок и их полной автоматизации.
Ионный обмен в умягчении воды.
В соответствии с современными воззрениями, для питьевой и хозяйственно-бытовой воды оптимальной является жесткость на уровне 1,5 мг-экв/л.
Практически для всех пищевых производств требуется мягкая вода. Для водочного производства установлена предельная жесткость 0,2 мг-экв/л, для производства соков — 0,7 мг-экв/л. для питания паровых котлов — 0,05 мг-экв/л и менее. Многие производители стараются использовать воду еще более высокого качества.
Наиболее просто снижение жесткости до практически любых значений обеспечивается ионным обменом. Производительность метода практически не ограничена.
Умягчение воды может производиться методами:
- Na-катионирования.
- H—Na-катионирования (параллельное или последовательное)
- Н-катионирования с голодной регенерацией на сильно- или слабокислотном катионите.
Как отмечалось выше, в соответствии с уравнением реакции, умягчение воды производится путем ее контактирования с сильнокислотным катионитом в Na-форме, в результате чего из воды извлекаются катионы Са 2+ и Mg2+ и замещаются ионом Na+. Солесодержание воды при этом практически не меняется, поскольку катионы Са2+, имеющие вес 1 мг-экв равный 20, замещаются катионом Na+ с весом 1 мг-экв, равным 23. Поскольку анионный состав не меняется, раствор остается практически нейтральным. Щелочность воды и рН может увеличиться на 0,1-0,2 единицы, в зависимости от содержания солей жесткости.
Интересным решением вопроса умягчения со снижением щелочности воды является Na-Cl-ионирование. Оно основано на применении для очистки воды катионита в Na-форме и анионита в С1-форме. Регенерация обоих ионитов производится одним и тем же раствором NaCI. В этом процессе протекают следующие суммарные реакции:
на катионите:
2R-Na + Ca(Mg)(HCO3)2 <-> R2-Ca(Mg) + 2NaHCO3 (1)
2R-Na + Ca(Mg)SО4 <-> R2-Ca(Mg) + Na2
2R-Na + Ca(Mg)(NО3)2 <->R2-Ca(Mg) + 2NaNО3 (3)
на анионите:
R-Cl + NaHCО3<-> R-НСОз + NaCl: (4)
2R-C1 + Na2SО4<-> R2-SO4 + 2NaCl; (5)
R-Cl + NaNО3<-> R-NO3 + NaCI. (6)
В результате реакций (1-3) с сильнокислотным катионитом обрабатываемая вода умягчается до заданного уровня, и в ней остаются только соли натрия. При их контактировании с сильноосновным анионитом в С1-форме происходит замена бикарбонатных, сульфатных и нитратных анионов на С1 (реакции 4-6). При сорбции бикарбонатного иона уменьшается щелочность воды, которая минимальна в начале цикла, а затем постепенно увеличивается. Время работы анионитного фильтра определяется повышением щелочности до заданного предела.
Метод Na-Cl-ионирования применяют при соотношении концентраций анионов в исходной воде НСО 3—/ SО42- + NО3— > 1 при суммарном содержании сульфатов и нитратов не более 3 мг-экв/л.
Поскольку регенерация катионита и анионита производится последовательно одним и тем же раствором соли, необходимо исключить образование осадка карбонатов кальция в слое катионита. Для этого регенерат после анионита подкисляют, разрушая бикарбонат-ионы. Также трудно сбалансировать объемы ионитов, чтобы они насыщались одновременно. При близких значениях жесткости и щелочности в исходной воде и вдвое-втрое большей емкости катионита, чем анионита, объем последнего должен быть в 2-3 раза больше.
Другими путями являются умягчение воды методами H-Na-катионирования (параллельным или последовательным), Н-катионирования с нейтрализацией, Н-катионирования с голодной регенерацией на сильно- или на слабокислотном катионите.
Эти способы позволяют свести щелочность к минимуму, а также уменьшить солесодержание воды. Их недостатком является потребность в больших количествах кислоты и специальном кислотостойком оборудовании. Для удаления образовавшейся углекислоты в буферных баках желательно установить распылительные головки или эжекторы-декарбонизаторы.
Н-катионирование воды позволяет полностью удалить жесткость и щелочность, а также снизить солесодержание. При контакте с катионитом в Н-форме из воды извлекаются все катионы, которые замещаются ионом водорода, рН раствора становится равным 2,5-4,0, в зависимости от исходного солесодержания. Во время очистки в воду выделяются катионы водорода, которые реагируют с бикарбонат-ионами по реакции:
HCО3— + Н+ -> Н2О + СО2 (7)
Кислотность воды велика, все бикарбонаты полностью переходят в растворенный углекислый газ, который отдувается в декарбонизаторе — ДКБ. Вода после декарбонизатора содержит только анионы сильных кислот и имеет кислую реакцию. Для ее нейтрализации в воду дозируют раствор щелочи. В результате очищенная вода имеет минимальную щелочность и жесткость, а содержание катионов соответствует первоначальному содержанию анионов сильных кислот. Снижение солесодержания соответствует исходной щелочности.
При необходимости поддерживать щелочность на определенном уровне при минимальной жесткости применяют параллельное или последовательное H-Na-катионирование (рис. 3.3, г, Э). Оба этих режима обеспечивают и некоторое снижение солесодержания воды.
При параллельном H-Na-катионирование часть раствора очищается Н-катионированием на сильнокислотном катионите, а другая часть умягчается Na-катионированием на таком же ионите. В воде, прошедшей через катионит в Н-форме, удаляются все катионы и вместо них в воду поступает катион водорода, рН раствора становится равным 2,5-4,0 в зависимости от солесодержания. Бикарбонаты полностью разрушаются и присутствуют в виде растворенной углекислоты. В воде, прошедшей через катионит в Na-форме, катионы солей жесткости заменены на натрий, рН не меняется. Обработанные растворы смешиваются в расчетных соотношениях и подаются на декарбонизатор, где удаляют углекислоту. Очищенная вода может иметь остаточную щелочность Щост менее 0,35 мг-экв/л.
Параллельное H-Na-катионирование используется тогда, когда необходимо иметь остаточную щелочность Щост менее 0,35 мг-экв/л; в исходной воде карбонатная жесткость составляет более 50%, а сумма концентраций солей сильных кислот — менее 5-7 мг-экв/л.
Последовательное H-Na-катионирование заключается в пропускании части питающего раствора через катионит в Н-форме, смешении подкисленного раствора с исходным, декарбонизации и умягчении всего потока на катионите в Na-форме. При подкислении воды при Н-катионировании частично разрушается бикарбонат-ион, и связанная с ним жесткость становится некарбонатной. Щелочность перед Na-катионированием поддерживается на уровне 0,7-1,0 мг-экв/л. Поскольку степень извлечения жесткости на Н-катионировании особого значения не имеет, регенерация кислотой может осуществляться без избытка. Такой способ умягчения используется для сильноминерализованных вод с солесодержанием более 1 г/л, когда карбонатная жесткость менее 50% от общей, а щелочность 0,7-1,0 устраивает потребителя.
Магнитное проеобразование воды:
В последние десятилетия, как в России, так и за рубежом, для борьбы с образованием накипи и отложений на внутренней поверхности труб и теп- лообменного оборудования применяют магнитную обработку воды. Ее широко используют в конденсаторах паровых турбин, парогенераторах низкого давления и малой производительности, тепловых сетях и системах горячего водоснабжения, в различных теплообменных аппаратах. Эффект, последствия обработки воды в магнитном поле известны давно. Еще в XIII в. были отмечены лечебные свойства «омагниченной» воды. Но только в ХХ в. началось использование магнитов в технике водоподготовки.
Первый патент на аппарат магнитной обработки воды был выдан в 1946 г. бельгийскому инженеру Т. Вермейрену, еще за 10 лет до этого обнаружившего, что при нагреве воды, пересекшей силовые линии магнитного поля, на поверхности теплообмена накипь не образуется.
Магнитная обработка воды в аппаратах с постоянными магнитами и электромагнитами применяется уже несколько десятилетий. Замечено, что при воздействии магнитного поля на солевые кристаллы последние меняют свою структуру: кристаллы становятся гораздо мельче, и кристаллы кальцита приобретают орагонитную форму. В целом кристаллы карбоната кальция вместо обычной накипи образуют рыхлую массу, легко вымываемую из трубопровода. Кроме того, образовавшаяся большая поверхность множества мелких кристаллов «конкурирует» за отложения с нагретой поверхностью. Более 70% частиц имеют размер менее 0,5 мкм.
Механизм воздействия магнитного поля на воду и содержащиеся в ней примеси окончательно не выяснен, но имеется ряд гипотез.
Современные воззрения объясняют механизм воздействия магнитного поля на воду и ее примеси поляризационными эффектами и деформацией ионов солей. Гидратация ионов при обработке уменьшается, ионы сближаются, образуя кристаллическую форму соли. В основу одной из теорий положено влияние магнитного поля на коллоидные примеси воды, другой — изменение структуры воды. При наложении магнитного поля в массе воды формируются центры кристаллизации, вследствие чего выделение нерастворимых солей жесткости происходит не на теплопередающей поверхности (нагрева или охлаждения), а в объеме воды. Таким образом, вместо твердой накипи в воде появляется мигрирующий тонкодисперсный шлам, легко удаляемый с поверхности теплообменников и трубопроводов. В аппаратах магнитной обработки вода должна двигаться перпендикулярно магнитным силовым линиям.
Умягчение воды
Методы до-котловой обработки воды с целью ее умягчения
Умягчение воды.
Умягчение воды — процесс, направленный на удаление из нее катионов кальция и магния, т.е. снижение ее жесткости.
По требованию САНПиН жесткость питьевой воды не должна превышать 7 мг–экв/л, а к воде, участвующей в процессах теплообмена выставляют требования глубокого ее умягчения, т.е. до 0,05…0,01 мг–экв/л. Жесткость воды, используемой для подпитки барабанных котлов ТЭЦ, не должна превышать 0,005 мг–экв/л, или 5 мкг–экв/л.
Снижение совокупной концентрации катионов Mg(II), Ca(II) и анионов, с которыми они при определенных условиях могут образовывать не стенках труб и аппаратов плотные нерастворимые отложения, проходит на системах водоочистки и водоподготовки различными методами, чей выбор определяется качеством исходной воды, требованию к ее очистке и технико–экономическими соображениями.
Метод ионного обмена.
В основе данного метода лежит способность некоторых материалов (катионитов и анионитов) поглощать из воды ионы (катионы и анионы) в обмен на эквивалентное количество ионов (катионов и анионов).
Процесс катионирования — тот процесс, при котором происходит обмен катионами. В водоподготовке при умягчении — катионами катионита на ионы Ca2+ и Mg2+ из воды.
Процесс анионирования — соответственно анионами, в основном при обессоливании и глубоком обессоливании.
Промышленные катиониты или т.н. ионнообменные смолы — это высокомолекулярные полимеры, макропористой или гелевой структуры и имеющие в своем составе функциональные группы, способные к ионному обмену.
Катионит, попадая в воду, начинает набухать. Происходит гидратация функциональных групп, освобождается небольшая доля энергии и возникают движущие силы, обусловленные разницей концентраций между внутренней набухшей частью зерна и окружающим его объемом воды.
Концентрация мобильных противоионов функциональных групп в зерновом пространстве имеет 1,5 – 6 г–экв/л. Стремясь к установлению равновесия, противоионы функциональных групп покидают частицы смолы, переходя в объем воды.
Схематично реакцию катионного обмена натрий-катионитового фильтра можно представить так:2Na[R] + Ca2+ → RCa + 2Na+
2Na[R] + Mg2+ → RMg + 2Na+,
где [R] – нерастворимая матрица полимера.
Прекращение миграции и процесса набухания смолы наступает в момент достижения условия минимального запаса энергии в системе. При этом внутри частицы смолы остаются аккумулированные противоионы с малым радиусом, вступившие в ассоциации с функциональными группами.
Чем больше динамическая активность ионов и их заряд, тем выше их энергия вхождения в катионит:
Na+4++ 2+ 2+ 3+ 3+
При условии одинаковых зарядов у ионов, энергия вхождения будет зависеть от их гидратации.
Для иона же водорода энергия вхождения в 17 раз выше, чем у натрия и в 4 раза, чем у кальция.
Как видно, селективность по катиону железа III выше, чем по катионам магния и кальция. Для исключения попадания на катионнообменную смолу большого количества железа, что приведет к снижению эффективности ее работы, необходимо предварительно обезжелезивать воду на установках обезжелезивания.
Важным параметром кинетики процесса ионного обмена является его скорость. На поверхности частицы, омываемой водой, образуется неподвижный слой водяной пленки. Катионам кальция и магния, для попадания внутрь зерна смолы, необходимо преодолеть этот слой. С увеличением скорости проходящей жидкости толщина неподвижной водяной пленки становится тоньше и ее преодоление для катионов из раствора становится легче.
Также на скорость диффузии катионов влияет температура воды — с ее ростом она увеличивается.
Большая скорость ионного обмена, ее повышение при увеличении температуры и скорости протока жидкости говорят о том, что при фильтровании через катиониты допустимы высокие скорости прохождения воды через фильтр.
Важная характеристика катионита — его удельная обменная емкость. Под этим понятием подразумевается то количество эквивалентных ионов жесткости, которое может обменять 1 м3 катионита. Выражается обменная емкость катионита в г–экв/м3 или г–экв/л.
Средняя обменная емкость катионитов, используемых в процессах водоподготовки, варьируется от 1,5 – 2,5 г–экв/л, что означает, что данные катиониты могут задержать на 1 литр набухшей смолы от 1,5 до 2,5 грамм–эквивалентов катионов.
Различают полную и рабочую обменную емкость катионитов.
Полная обменная емкость — это все то возможное количество грамм-эквивалентов катионов, которое может быть уловлено 1 м3 катионита до окончательного исчерпания своего ресурса, т.е. до того момента, пока жесткость воды на выходе не будет равна жесткости воды на входе.
Рабочая обменная емкость катионного фильтра выражает то количество грамм–эквивалентов катионов, которое может задержать 1м3 катионита до момента их проскока, т.е. до того момента, когда жесткость воды на выходе начнет расти.
Аналогично полная и обменная емкость поглощения являются обменными емкостями катионитового фильтра, указывающие, какое количество катионов может задержать данный фильтр.
Как правило, указываемая производителем обменная емкость данного катионита относится к катиониту уже в набухшем состоянии, т.е. к катиониту, находящемся в рабочем виде.
Рассмотрим работу катионитового фильтра.
В процессе фильтрования воды через неистощенный катионитовый фильтр различают три рабочих зоны катионита.
Вода, проходя сверху вниз, умягчается до некоторой глубины. Этот слой смолы, участвующий в умягчении воды, называют работающим слоем или зоной умягчения.
Далее умягченная вода проходит сквозь слой свежего катионита.
Постепенно верхние слои истощаются, и границы зон умягчения и свежего катионита опускаются ниже. Через какое-то время часть работающего катионита истощается. По факту в работающем катионитовом фильтре мы наблюдаем три зоны: истощенной, работающей и зоны свежего катионита.
Полное умягчение воды будет проходить до того момента, пока нижняя граница работающего слоя не совместиться с нижним слоем смолы. В этот момент начнется «проскок» ионов Ca2+ и Mg2+, что приведет к увеличению остаточной жесткости воды, которая начнет расти, пока не станет равной жесткости исходной, что будет свидетельствовать о полном истощении фильтра.
Рабочая обменная емкость фильтра Ep, г–экв/л, выражается следующим уравнением:
Ер=Q*Жи или Ер = ер*Vк,
где Q — количество умягченной воды;
Жи — жесткость исходной воды;
ер — рабочая обменная емкость загруженного катионита;
Vк — объем катионита в фильтре, находящегося в набухшем состоянии (т.е. в рабочем).
Vк = аф*hк, где
аф – площадь фильтра, м2;
hк – высота слоя катионита, м.
Преобразовав вышеприведенные выражения, получим формулу рабочей обменной емкости катионита: еp = Q*Жи/aф*hк.
Зная скорость потока воды vк через катионитовый фильтр, можно определить количество воды, которое может быть умягчено:
Q = vк*аф*Тк = ера*ф*h*к/Жи,
откуда определим время работы Тк:
Тк = ер*hк/vк*Жи.
Время работы катионитового фильтра является межрегенерационным циклом фильтра. По истечении этого времени или по проходе через фильтр того количества воды, которое может быть умягчено, фильтр подвергается регенерации соляной, серной кислотой или раствором поваренной соли.
В зависимости от качества воды и заданной степени ее очистки применяют натрий-катионирование, водород-катионирование, анионирование и совместную работу фильтров данного типа.
Пример схем работы промышленных или бытовых фильтров умягчения.
Магнитная обработка воды.
Использование магнитной обработки воды целесообразно в случае высокой кальциево-карбонатной жесткости.
В процессе прохождения воды сквозь магнитное поле в ней образуются центры кристаллизации, которые укрупняются и выпадают в неприкипающий шлам, удаляемый при продувке. Т.е. выделение осадка идет не на стенках поверхности нагрева, а в объеме воды.
Влияние на противонакипный эффект оказывают такие факторы, как качественный и количественный состав воды, скорость движения жидкости сквозь магнитные силовые линии, напряженность магнитного поля и время пребывания в нем воды.
Условиями для осуществления успешной магнитной обработки воды должно являться высокое содержание карбоната и сульфата кальция, а концентрация свободного оксида углерода IV должна быть меньше равновесной. Так же увеличивают противонакипный эффект содержащиеся в воде примеси оксидов железа и прочих.
Аппараты магнитной обработки воды работают как на основе постоянных магнитов, так и на основе электромагнитов. Недостатком аппаратов с постоянными магнитами является то, что время от времени их приходится чистить от ферромагнитных примесей. Электромагниты чистят от оксидов железа, отключив их от сети.
Скорость воды в магнитном поле при ее обработке не должна превышать 1м/с. Для увеличения объема обрабатываемой воды на единицу времени применяют аппараты с послойной магнитной обработкой.
Метод магнитной обработки нашел применение на тепловых сетях горячего водоснабжения, на ТЭЦ, в теплообменных аппаратах.
Выбор данного метода при решении задачи умягчения воды должен главным образом основываться на его эффективности при очистке воды данного качества – использоваться как основной, последующей ступени или в качестве дополнительного.
Обратный осмос.
В данное время наиболее широкое распространение в водоподготовке получил метод обратного осмоса.
Суть метода состоит в том, что под высоким давлением, — от 10 до 25 атмосфер, — вода подается на мембраны. Мембраны, являясь селективным материалом по отношению к проходящим сквозь нее примесям, пропускают молекулы воды и не пропускают растворенные в воде ионы.
Таким образом, на выходе после установки обратного осмоса мы получаем два потока — первый поток чистой воды, прошедшей сквозь мембрану, так называемый пермеат, и второй поток — воды с примесями, не прошедшей сквозь мембрану, называемый концентратом.
Пермеат направляется потребителю и составляет от 50 до 80 % от объема подаваемой воды. Его количество зависит от свойств мембраны и ее состояния, качества исходной воды и желаемого результата очистки. Чаще всего это около 70%.
Концентрат, соответственно, от 50 до 20%.
При увеличении нагрузки на мембрану, т.е. увеличения процентного соотношения между пропускаемой водой и водой с примесями, селективность мембраны снижается и достигает минимума при отсутствии концентрата, т.е. тогда, когда вся вода, подающаяся на установку обратного осмоса, проходит сквозь мембрану.
Мембраны обратного осмоса изготовляются из композитного полимерного материала особой структуры, позволяющего при высоких давлениях пропускать воду и не пропускать растворенные в ней ионы и прочие примеси. При увеличении нагрузки на мембрану срок ее службы сокращается, а при достижении критических параметров, при которых попускаемая жидкость с примесями проходит сквозь мембрану полностью, она разрушается. Средний срок службы мембраны — 5 лет.
Поверхность мембран со временем может обрастать микроорганизмами, покрываться слоем труднорастворимых соединений. Для чистки обратноосмотических мембран применяют растворы кислот и щелочей с добавлением биоцидов.
При промывки обратного осмоса нельзя забывать, что полупроницаемая мембрана — это не фильтр. Промывка должна проводиться исключительно по ходу движения жидкости. Обратный ток раствора воды приведет к выходу мембраны из строя.
Реагентные методы обработки воды.
Реагентные методы обработки воды служат в основном для неглубокого умягчения воды путем добавления реагентов и перевода солей жесткости в малорастворимые соединения с последующим их осаждением.
В качестве реагентов используется известь, сода, едкий натр и пр. В настоящий момент мало где применяются, но для общего понимания процессов перевода в малорастворимые соединения кальция и магния и дальнейшее их осаждение, рассмотрим их.
Снижение накипи известкованием.
Метод применим к воде с высокой карбонатной и малой некарбонатной жесткостью.
При добавлении известкового молока pH воды повышается, что приводит к переходу растворенного диоксида углерода и гидрокарбонатного иона в карбонатный ион:
СО2 + ОН— = СО32- + Н2О,
НСО3- + ОН— = СО32- + Н2О.
При насыщении воды карбонатными ионами кальций выпадает в осадок:
Са2+ + СО32- = СаСО3↓.
Также с увеличением рН в осадок выпадает и магний: Мg2+ + OH— = Mg(OH)2↓.
В случае, если превышение карбонатной жесткости незначительно, то вместе с известью дозируют соду, чье присутствие снижает некарбонатную жесткость:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl,
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4.
Для более полного осаждения катионов магния и кальция рекомендуется подогревать воду до температуры 30 – 40 градусов. С ее повышением растворимость CaCO3 и Mg(OH)2 падает. Это дает возможность снижать жесткость воды 1 мг–экв/л и менее.
Содово-натриевый метод умягчения воды.
Добавление соды необходимо в том случае, если некарбонатная жесткость больше чем карбонатная. При равенстве этих параметров добавление соды может и не понадобиться совсем.
Гидрокарбонаты кальция и магния в реакции со щелочью образуют малорастворимые соединения кальция и магния, соду, воду и углекислый газ:
Ca(HCO3)2 + 2NaOH = CaCO3↓ + Na2CO3 + 2H2O,
Mg(HCO3)2 + 2NaOH = Mg(OH)2↓ + Na2CO3 + H2O + CO2↑.
Образовавшийся в результате реакции гидрокарбоната магния с щелочью углекислый газ снова реагирует с щелочью с образованием соды и воды:
CO2 + NaOH = Na2CO3 + H2O.
Некарбонатная жесткость.
Сульфат и хлорид кальция реагирует с образовавшейся в реакциях карбонатной жесткости и щелочи содой и добавленной содой с образованием неприкипающего в щелочных условиях карбоната кальция:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl,
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4
Сульфат и хлорид магния реагируют со щелочью, образуя выпадающий в осадок гидроксид магния:
MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4 ,
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl .
Ввиду того, что в реакциях гидрокарбоната с щелочью образуется сода, которая в дальнейшем реагирует с некарбонатной жесткостью, ее количество необходимо коррелировать в соотношении карбонатной и некарбонатной жесткости: при их равенстве соду можно не добавлять, при условии Жк > Жнк образуется избыток соды, при обратном соотношении Жкнк – недостаток, и соду необходимо добавлять.
Комбинированные методы.
Сочетание различных методов обработки воды с целью снижения ее жесткости дает в иной раз довольно высокую результативность. Обусловлено это, как правило, высокими требованиями к качеству воды и пара.
Примером может быть сочетание обратного осмоса с натрий-катионированием. Основная жесткость воды снижается на фильтрах-катионитах, на обратном осмосе идет ее обессоливание.
В другом случаем в качестве дополнительной ступени очистки может служить магнитная обработка воды – установку располагают после системы умягчения на трубопроводе циркуляции горячего водоснабжения.
Статью подготовил:
Руководитель ПТО
OOO «CАТ»
Макаров Василий А.
8-905-282-32-19
Нужна консультация? Свяжитесь с нами!
Телефон: +7 905 282 32-19
Email: [email protected]
«Как смягчить жесткую воду?» – Яндекс.Кью
Жёсткая вода содержит так называемые соли жёсткости — минеральные соединения, образованные кальцием и магнием. Жёсткая вода называется так за свою способность делать жёсткой одежду, что происходит из-за образования нерастворимых солей кальция и магния с жирными кислотами загрязнений одежды, оседающих в её тканях. Стоит отметить, что различают постоянную и временную жёсткость: временная жёсткость формируется гидрокарбонатами кальция и магния (Ca/Mg(HCO3)2) — эти соли могут быть удалены кипячением; сульфаты и хлориды кальция и магния (Ca/MgSO4/Cl2) не удаляются кипячением и образуют постоянную жёсткость.
• Проще всего использовать термоумягчение. Соли жёсткости могут оседать на поверхностях при нагревании — так образуется налёт в стиральных машинах — так можно очищать питьевую воду простым кипячением (впрочем, будет страдать чайник) по реакции:
Ca(HCO3) t° → CaCO3↓ (накипь) + h3O + CO2.
Правда, помогает это лишь отчасти: удаляется только карбонатная жёсткость.
• В домашних условиях лучшим методом является реагентное умягчение. Из подручных средств можно использовать кальцинированную соду Na2CO3 (не обычную домашнюю NaHCO3) или гашёную известь Ca(OH)2. С этими реагентами происходит реакция, подобная образованию накипи. Лучшим реагентом является вещество, входящее в состав практически всех смесей для удаления накипи, таких как всем известный Калгон, — натрия ортофосфат или лучше натрия трифосфат. Это вещество можно купить в химическом магазине банкой за намного меньшие деньги и в намного больших объёмах, чем средства для удаления накипи. Правда, при неправильной дозировке фосфаты натрия защелачивают воду, а слишком мягкая вода вредна для здоровья и труб не меньше, чем жёсткая.
— Во всех приведённых случаях воду после обработки нужно профильтровать, потому что удаление солей жёсткости происходит именно в сторону образования осадка (накипи), который нужно удалить.
• В промышленности применяют методы катионирования, обратного осмоса и электродиализа — в этих случаях происходит обмен катионов магния и кальция на другие, не обладающие ожесточающими свойствами. Кроме того применяется дистилляция — можно сказать, что это продвинутый метод кипячения, при котором используется не прокипячённая вода, а сконденсированный пар — абсолютно чистая h3O.
Жесткая вода. Для чего умягчают воду? ВодаБаст ЧП «Водяной сервис», Минск, РБ
Начнем с определения.
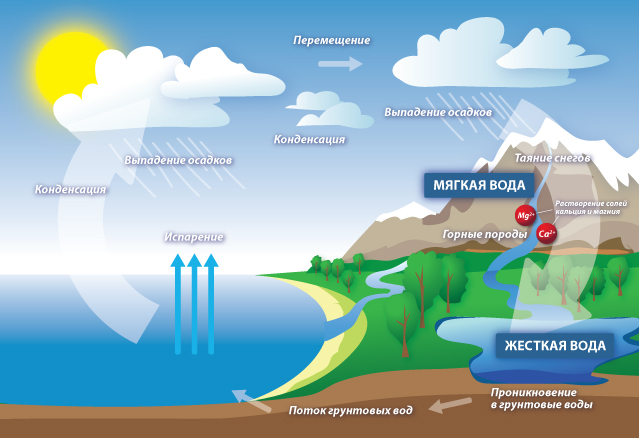
Жёсткость воды — совокупность физических и химических свойств воды, связанных с наличием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Источником повышенной жесткости воды является сама природа. Вода в земле походит через известковые залежи и рудоносные породы и в результате насыщается а чаще перенасыщается различными минералами. От характера и состава проходимых залежей зависит качественный минеральный состав воды и в исключительных случаях мы получаем минеральную воду. Однако всем известно, что минеральную воду следует употреблять в небольших количествах. Ну а если состав представлен главным образом в виде растворенного мела и известковых образований, то полезность такой «минералки» ставится под сомнение. В результате, при высоком содержании солей жесткости, имеют место следующие последствия:
Для здоровья
У жесткой воды горьковатый вкус и после употребления во рту и на зубах остается ощущение осадка. Чай, кофе имеют характерную пленку на поверхности и вкусовые качества этих и других напитков, приготовленных на жесткой воде, оставляют желать лучшего. Сильно жесткая вода сказывается на здоровье органов пищеварения и мочеиспускательной системы. Кроме того, купание в жесткой воде сказывается на здоровье кожи и волос. После купания возникает ощущение сухости кожи и ломкости волос. Что происходит если намылить жесткую воду? Она побелеет. Соли жесткости и мыло образуют вместе мыльные шлаки, которые остаются на поверхности кожи, забивая поры и вызывая сухость и раздражение. Эти шлаки полностью не выполаскиваются из тканей, мы видим их на поверхности посуды и сантехники.
Для стирки и мытья посуды
Стирка в жесткой воде приводит к преждевременному износу одежды. Все потому что жесткость воды действует на ткань как наждачная бумага. Вещи теряют цвет вследствие отложения тех же солей, только на поверхности тканей. К тому же всем хозяйкам известно, что расход моющих средств на стирку в жесткой воде значительно больше. Однако многие не знают, что современные порошки содержат детергенты — химические добавки для умягчения воды. При полоскании эти вещества полностью не выполаскиваются из волокон, в итоге после стирки одежда не только теряет первоначальный цвет и быстро изнашивается, но и может раздражать кожу.
Для дома Кальций и магний при нагревании и кипячении выпадают в осадок и приводят к образованию известкового налета на стенках водопроводного и отопительного оборудования, теплообменниках котлов, внутри сантехнических приборов. Зарастание нагревающих поверхностей приводит к снижению КПД теплового оборудования. При испарении воды кальций и магний оставляют известковые разводы на керамической плитке, смесителях, посуде и на поверхности всего, что взаимодействует с водой.
Кальций и магний при нагревании и кипячении выпадают в осадок и приводят к образованию известкового налета на стенках водопроводного и отопительного оборудования, теплообменниках котлов, внутри сантехнических приборов. Зарастание нагревающих поверхностей приводит к снижению КПД теплового оборудования. При испарении воды кальций и магний оставляют известковые разводы на керамической плитке, смесителях, посуде и на поверхности всего, что взаимодействует с водой.
Процесс удаления из воды солей кальция и магния в водоочистке называют умягчением. Существует три общепризнанных метода очистки воды от солей жесткости:
- Реагентное умягчение
- Очистка на основе ионного обмена
- Очистка нано- или ультрафильтрацией
Реагентное умягчение воды подразумевает под собой добавление в воду определенных химических реагентов, которые выводят соли жесткости из растворимого состояние в нерастворимое. При этом осаждаются взвешенные, коллоидные и частично органические вещества. Эти реакции протекают в специальных крупногабаритных осветлителях и отстойниках. Осаждение веществ протекает медленно и требует постоянного контроля. Вода, очищенная таким образом, не может быть использована для бытовых и питьевых целей, так как имеет сильнощелочную реакцию. Поэтому данные методы умягчения применяются исключительно в промышленности и энергетике.
Ионный обмен для умягчения воды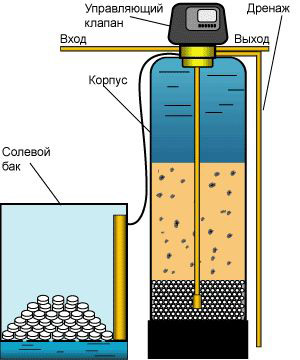
Умягчение воды данным методом заключается в прохождении потока воды через специальную фильтрующею среду — ионообменную смолу. Ионообменная смола – выглядит как скопление маленьких полимерных шариков и по внешнему виду напоминает щучью икру. На поверхности смолы происходит реакция ионного обмена — катиониты кальция и магния замещаются ионами натрия, поэтому общее солесодержание не изменяется и вода остается нейтральной и безопасной с незначительным увеличением рН на 0,1-0,2 единицы. Разница в том, что остающийся в воде ионы натрия образуют соли, которые не относятся к солям жесткости и не оставляют накипи и известковых отложений и разводов. Когда ионы натрия заканчиваются, умягчающая способность смолы утрачивается. Для восстановления функции умягчения производиться зарядка смолы новыми ионами натрия. Данный процесс называется регенерацией и заключается в промывке ионообменной смолы раствором поваренной соли NaCl. В результате проходит обратная реакция смола отдает воде ионы кальция и магния и забирает у соли ионы натрия. Далее вода перенасыщенная солями жесткости смывается в канализацию, а смола снова готова к умягчению воды.
Визуально оборудование по умягчению воды выглядит следующим образом: полимерный корпус фильтра с ионообменной смолой внутри, электронный блок управления (управляющий клапан), отвечающий за автоматизацию процессов фильтрации и регенерации и бак для приготовления солевого раствора и подачи в корпус. В бак засыпается таблетированная соль с запасом на несколько месяцев. Все что нужно от человека использующего такой фильтр – это один раз включить его в розетку и периодически добавлять соль в бак. Все остальное система выполнит сама!
ПОСМОТРЕТЬ ВЕСЬ АССОРТИМЕНТ СИСТЕМ И СТАНЦИЙ УМЯГЧЕНИЯ ВОДЫ
 Умягчение воды на основе нанофильтрации (ультрафильтрации)
Умягчение воды на основе нанофильтрации (ультрафильтрации)
Системы обратного осмоса относятся к методам очистки воды на основе ультрафильтрации. Они прекрасно справляются не только с бактериями, вирусами, пестицидами, нефтепродуктами, нитратами и нитритами. Обратный осмос прекрасно фильтрует воду от солей жесткости. Размеры молекул солей жесткости больше молекулы воды, поэтому вода после такой очистки мягкая и приятная на вкус.
Системы обратного осмоса это не только небольшие фильтры для приготовления питьевой воды, установленные под кухонной мойкой. Это может быть целый комплекс оборудования с высокопроизводительными крупногабаритными мембранами, насосным оборудованием и прочей электроникой. Но умягчение больших объемов воды с помощью нанофильтрации — удовольствие не из дешевых и применяется главным образом на предприятиях пищевой промышленности. В быту же обратный осмос имеет назначения как фильтра для питьевой воды. Средняя производительность таких фильтров 150 литров в сутки, что более чем достаточно для питьевого водоснабжения дома или квартиры.
Посмотреть перечень систем обратного осмоса можно здесь!
Электрохимический метод умягчения воды
Относительно новый метод умягчения воды и заключается в том, что жесткая вода, проходя через межэлектродное пространство, подвергается ряду физико-химических процессов, благодаря которым соли жесткости переводятся из растворимого состояние в нерастворимое. Данный метод, как и реагентная очистка, используется главным образом в промышленности.
Вы познакомились с основными методами умягчения воды. Теперь давайте ответим на вопрос «Как решать проблему высокого содержания солей жесткости в воде?»
Самым оптимальным по «цена-качество» решением для частного дома или квартиры является установка автоматической системы умягчения, на основе ионообменной фильтрующие загрузки .
Мягкая вода в вашем доме это здоровье и комфортное купание, так как мягкая вода не сушит кожу. При высыхании жесткой воды на стеклянной поверхности отчетливо видимы известковые разводы. Тоже самое происходит с кожей и волосами. Остатки солей раздражают и сушат кожу, приводят к ломкости волос. При использовании системы умягчения воды – эта проблема будет решена.

Мягкая вода — это увеличение срока службы всего сантехнического оборудования и водонагревательных элементов в системе горячего водоснабжения и отопления и как следствие отсутствие затрат на ремонт техническое обслуживание.
Если Вы используете мягкую воду, вы снижаете расходы на отопление и обогрев воды, так как КПД котлов и водонагревателей в мягкой воде выше.
При стирке в мягкой воде ваша одежда не только лучше отстирывается, но и происходит значительная экономия моющих средств, нет необходимости добавлять искусственные химические добавки типа калгон для деструктуризации солей жесткости.
Если вы используете умягченную воду, помимо увеличения срока службы оборудования, вы снизите затраты на энергооборудование до 15%.
ЧТО ВЫБИРАЕТЕ ВЫ???
У Вас возникли вопросы? Мы всегда готовы на них ответить! Звоните + 357 (29) 657-19-00 или ОСТАВЬТЕ СВОЙ ВОПРОС и с вами свяжутся для консультации
Умягчение воды. Умягчение воды в домашних условиях. Что такое умягчение воды
АкваЩит — Умягчение воды
Вода — неотьемлемая часть нашей жизни. Сегодня ее, где только не используют. Это и промышленность, и быт, и непосредственно использование в еду и питье. Естественно, что вопросам ее очистки уделяется очень много внимания. Каждый из нас видел, в каком состоянии у нас реки, протекающие через города и села. И даже если они прозрачны, то тут, то там возникают обьявления о холерной палочке и тому подобных болезнях. То есть вода из любого первичного источника, в том числе из артезианской скважины будет жесткой. А значит, умягчение воды станет необходимостью, если вы хотите сократить свои расходы и заодно защитить себя от влияния повышенной жесткости воды.
Умягчению воды и его видам мы и посвятим эту статью. Но сперва разберемся, что собой представляет жесткая вода, в чем ее вред и почему умягчение воды считается единственным качественным способом снизить жесткость воды. Итак, жесткой воду делают две соли. Причем это не просто включение солей кальция и магния, это превышение допустимых пределов жесткости воды. Вода может быть мягкой, жесткой и очень жесткой. Умягчение воды необходимо всем тем, у кого показатель жесткости колеблется от просто жесткой воды до очень жесткой.
Казалось бы, воду забирают не просто из первичного источника, а из артезианской скважины. Откуда там могут взяться соли кальция и магния? Откуда вообще вода появляется в артезианской скважине? Здесь несколько вариантов. Это вода из подземных рек, или вода, прошедшая сквозь почву, после таяния ледников. Нужно помнить, что вода является одним из самых лучших естественных растворителей. И вот когда вода течет, пропитывает почву и по пути к скважине встречает залежи полезных ископаемых там, и она и набирает свой состав, становится железистой или чересчур жесткой. Так или иначе, но вода из источника — это всегда вода с определенным составом примесей. Причем для здоровья такой состав может быть полезным в малых дозах, а вот для промышленного оборудования может быть губительным.
Что касается воды не из скважины, то там все намного печальнее. В воде, что только не встретишь, и на высокую степень прозрачности воды также рассчитывать не приходится. Когда вода поступает к нам из централизованной системы очистки воды, то там она уже прошла определенные стадии чистки. К сожалению, водоподготовке с помощью АкваЩит у нас не уделяют много внимания, из-за устаревших систем и из-за дороговизны системы очистки и умягчения воды. Да и с хлоркой в качестве дезинфектора часто усердствуют. В результате имеем жесткую воду, которая образует накипь.
Зачем нам так нужно понимать умягчение воды, что это такое? Здесь вся проблема состоит в том, что жесткая вода имеет недостатки и это не только накипь. Из-за этих проблем и пришли к изобретению умягчителей воды. Поэтому разбираться будем постепенно. Определимся сперва с жесткой водой.
Она негативно влияет еще до того, как образуется известковый налет. Ваше здоровье и вещи ощутят влияние повышенной жесткости воды по полной программе. Они, по сути, и будут поверхностями, куда соли жесткости выпадут, образуя нерастворимый осадок. В бытовых приборах, это нагревательные элементы и поверхности. В человеческом организме – кожа, волосы и внутренние органы. В тканях, поры тканей при стирке.
Соли жесткости оседают на любых поверхностях. Постоянное употребление жесткой воды в пищу стимулирует образование язвы, камней в почках и т.п. болезней не хуже употребления соленого и острого в больших количествах. Да и кожу очень сильно сушит. Все эти причины и вызвали так сказать развитие технической мысли. Ведь для человеческого организма любое удаление накипи безразлично. Ведь оно проходит уже после использования жесткой воды в пищу. В данном разделе мы рассмотрели информацию про умягчение воды. Надеемся, вы все поняли.
Цены на умягчение воды
Теперь, что касается цен на умягчение воды и быстрой изнашиваемости вещей, из-за высокой жесткости. Такая вода крайне плохо растворяет любые моющие вещества. Даже голову помыть в такой воде проблематично. Думаю, каждый замечал, насколько плохо мылится любой шампунь в жесткой воде. Тот же примерно эффект происходит и при стирке. Соли жесткости застревают в порах тканей, не давая и грязи вымываться и порошку. В результате на поверхностях образуется белое пятно. Многим кажется, что это плохо выстиранный порошок. Но пятно так просто не удаляется, т.к. кроме порошка там еще и соли жесткости находятся. В результате и ткани быстрее изнашиваются, и вещи выглядят блекло и некрасиво. Поэтому, не стоит экономить на цене на умягчение воды. Потом будете платить вдвойне.
Но кроме этого у накипи есть еще такой недостаток, как плохая проводимость тепла. То есть она полностью блокирует нормальную работу любого бытового прибора. В то время, как умягчение воды устраняет из нее излишек солей жесткости до того, как жесткая вода поступит в бытовой прибор или к вам в чашку. Потому оно сегодня так стремительно набирает популярность. Хотя цены на умягчение воды и высокие, но тем не менее оно пользуется популярностью у предприятий и у владельцев коттеджей.
Из-за плохой теплопроводимости, в любом бытовом приборе или оборудовании на предприятии начнет резко расти расход топлива. Увеличится время нагрева воды, причем это произойдет довольно резко. И чем больше будет слой накипи, тем хуже будет нагрев и тем дольше он будет. Закрывая нагревательный элемент плотным слоем, накипь не дает ему отдать тепло воде. Но кроме этого, сама поверхность будет находиться в условиях практически экстремальных. Температура нагрева ведь не будет оставаться на месте. Разогреваться вечно, поверхность не сможет. И в результате прибор перегорит.
В промышленности последствия отложения накипи выливаются в куда более худшие последствия. Там трубы стираются в буквальном смысле. А котлы в котельной могут взорваться от перегрузок. Поэтому единственным правильным решением для промышленности или дома, когда есть острая необходимость устранить повышенную жесткость воды, это расчет и цены на умягчитель воды. Надеюсь, вы поняли, что цены на умягчение воды хоть и высокие, но экономить тут не стоит.
Умягчение воды в домашних условиях
Чтобы защитить себя со всех сторон, запомните, что качественное умягчение воды в домашних условиях или в квартире ли, на предприятии ли не может состоять из одного умягчителя воды. Вам все равно придется, либо проводить полный цикл очистки воды, либо устанавливать один умягчитель воды для парового и водогрейного котла, и один для производства питьевой воды.
Кроме того, что накипь стимулирует повышенный расход топлива, а также может привести к поломке прибора, она также способствует развитию коррозии. Потом нельзя удалять накипь вечно. Поверхности тоже страдают. Вы снимаете с них защитных слой, царапаете поверхность, нарушаете целостность. От этого приборы будут хуже работать. И это все последствия только от удаления накипи и не во время выполненного удаления накипи. Это отнюдь не самая полезная и главное дешевая процедура. Вот все эти факты и заставили задуматься человечество о путях избежания появления такого последствия, как накипь. Так изобрели умягчение воды в домашних условиях.
Итак, умягчение воды, что это такое? Это устранение из воды излишка солей жесткости, путем химического воздействия или естественных физических процессов. На сегодня умягчение воды в домашних представлено двумя большими группами. Это реагентные способы, которые работают с помощью различных химикатов и реакций с ними. И группа безреагентных фильтров для воды. Последние используют в работе исключительно естественные процессы и расхода реагентов не требуют.
К реагентным фильтрам для воды относят ионообменные установки, потом озонаторы, фосфатирование, хлорирование. Все это варианты умягчения воды в домашних условиях с помощью химических веществ. Во время очистки воды или восстановления могут использоваться различные реагенты. Они вступают в реакцию с солями жесткости, образуя новые вещества. Тогда умягчение воды в домашних называется реагентным.
Безреагентное умягчение воды в домашних условиях, что это такое? Тот же самый процесс устранения излишка жесткости путем преобразования формы кристаллов солей жесткости, которое позволяет не прилипать им к поверхностям оборудования. В качестве примера подобных умягчителей можно упомянуть – магнитную установку, электромагнитный умягчитель воды АкваЩит, ультразвуковой прибор. Работают они на одном принципе. Только силы используют в работе разные. Разве только магнитные и электромагнитные силовые поля являются родственными.
Итак, умягчение воды, что это такое? Мы постарались ответить на этот вопрос более подробно. Ниже рассмотрим самые популярные фильтры для воды, их достоинства и недостатки, как варианты умягчения воды в домашних условиях. И еще один вопрос, который заботит, пожалуй, каждую хозяйку, в сегодняшних реалиях. Умягчение воды своими руками, возможно ли сегодня подобное?
Что вам сказать на этот вопрос… Пока не изучили полезные свойства магнитов, пока не знали, как работает ионообменная смола с солями жесткости, к очистке воды тоже старались подходить по мере своих возможностей. Делали простейшие фильтры из разнообразных засыпок. Применяли и уголь, и песок, и гравий. Правда, к умягчению воды это имело отдаленное отношение. Впрочем, воздействие магнита на воду так и открыли, путем проб и ошибок.
С уверенностью можно сказать, что в современных условиях умягчение воды в домашних условиях практически невозможно. Единственный наиболее подходящий к этому понятию вариант – это применение кремния в качестве очистителя. Если вы слышали когда-нибудь про кремниевую воду, то вот она обладает как раз не только свойствами лечебной воды. Это еще и мягкая вода. И очистку от излишка солей жесткости здесь производит именно кусочек кремния. Все, что вам для этого нужно, это бросить небольшой кусок кремния(чистого!) в трехлитровый бутыль воды и подержать его там несколько дней. После этого вода станет мягкой, и ее можно будет использовать просто для питья, и для готовки.
Что такое умягчение воды
Теперь узнаем, что такое умягчение воды. Мы знаем, что большое содержание солей жесткости, это вредно. Но что это такое умягчение воды? Как мы понимаем, скорость подобной очистки воды очень медленная. Поэтому такую очистку можно использовать просто для лечения, но не в качестве постоянного очистителя воды. Есть для домашних условий специальные порошки – умягчители воды своими руками. Но отнести их к понятию что такое умягчение воды своими руками вряд ли возможно. Так, что сегодня умягчить воду можно только путем установки фильтра для воды.
Какие же способы умягчения воды используют в основе фильтров для воды? Химический способ как было сказано выше, является основой для ионообменного умягчителя. Такой вид фильтров в быту практически не встречается, за исключением фильтра-кувшина. Любое использование химикатов при производстве мягкой воды сразу же пресекает ее применение в качестве питьевой.
Почему же тогда можно использовать ионообменный фильтр-кувшин? И что такое умягчение воды? Здесь вся разница с другими подобными установками состоит в том, что фильтр не восстанавливают в конкретной модели, а меняют. В промышленности же в водоподготовке использовать сменные фильтры – большая роскошь. И там их восстанавливают и снова пускают в ход. На восстановление тоже тратят немалые деньги. Хоть и регенератором является обычная соль. Но ее обьемы в промышленных масштабах, выливаются в крупные суммы. И восстановление приходится проводить чаще. Правда у подобных ионообменных установок есть и свои плюсы. Понижать степень жесткости воды, можно чуть ли не до нуля. Но тогда вода будет слишком натриевой. И еще такой вид очистки воды один из самых быстрых. Другие фильтры так быстро не работают.
Теперь, что касается непосредственно процесса очистки. Внутри фильтра-кувшина располагается картридж с ионообменной смолой. Она специально обогащена натрием, который внутри структуры очень плохо держится. Когда в такой фильтр поступает жесткая вода, происходит смена одних ионов на другие. Фильтр постепенно забивается. Когда он полностью отдаст свой натрий, приходит время его менять. Это тоже расходы. И немалые. Т.к. стоит картридж как треть самой установки, хоть она и дешевая. Однако постоянно возиться с заменами вряд ли кому то захочется. Да и воды очищенной хватит только на личное потребление.
Следующий бытовой фильтр для умягчения воды – безреагентный. Пример – магнитный или электромагнитный умягчитель воды АкваЩит. У магнитного основа, как вы понимаете мощные постоянные магниты. Делают их из качественных редкоземельных металлов. Они почти не теряют магнитных свойств за годы работы. Это позволяет использовать магнитную установку в течение четверти века без всяких замен и восстановлений. Кстати большая простота использования, отсутствие обслуживания является одним из главных козырей что магнитного, что электромагнитного умягчителя. Вы поняли, что такое умягчение воды и цена на него.
Такой прибор не требует врезания в трубу, он просто одевается на трубу, работать начинает мгновенно. Ему не нужны чистки, восстановления и промывки. Это прибор, который можно поставить и забыть о нем на 25 лет. Он занимает мало места, а магистральные модели в состоянии очищать большие обьемы воды.
Устанавливая такой прибор, обязательно проверьте свою трубу. Внутри не должно быть старой накипи, если она есть, ее нужно убрать, но только на этом отрезке трубы, куда вы будете монтировать устройство. Через старую накипь магнитное поле не сработает.
К огромным плюсам магнитного прибора относят и тот факт, что он позволяет не только умягчать воду. Под воздействием магнитных силовых полей, кристаллы солей жесткости начинают меняться. Из удобных плоских прямоугольников, они превращаются в тонкие, острые иглы. Прилипать к поверхностям не получается. Неудобно, да и нечем. Но иголки продолжают тереться о поверхности. При этом они очень качественно устраняют старую накипь, не оставляя после себя следов. Чистка происходит на молекулярном уровне. Такие приборы из-за такого двойного эффекта в работе получили большую популярность в теплоэнергетике и быту. Но используют больше электромагнитный умягчитель воды АкваЩит, а не его магнитный аналог.
Выбор падает на электромагнитное устройство потому, что требований к воде у него намного меньше. Он работает и с горячей водой, и водой, текущей в двух направлениях. Также ему неважно, с какой скоростью течет вода. Так, что это такое умягчение воды с помощью электромагнитного прибора всегда предпочтительнее.
То есть, умягчение воды предназначено для защиты нашего здоровья и бюджета от вредных последствий повышенной жесткости воды. Установив водоподготовку в квартире или на производстве, мы сознательно выбираем качественную чистку воды, которая поможет нам сохранить здоровье и гарантирует нам качество продукции, которую мы будем производить. Из данной статьи мы знали, что такое умягчение воды и почему так важно его делать.
Способы умягчения воды, эффективные и не очень
Одной из труднорешаемых проблем на сегодня является плохая вода. Массовое ее использование подразумевает обязательное использование воды хорошего качества, но в реалиях, на кухнях и в ванных применятся вода совсем иного качества. Централизованная система очистки воды поставляет на предприятия и для частного использования, воду с высоким порогом жесткости.
Что делать с известковостью?
Итак, есть исходные данные. В дом, в квартиру поступает вода низкого качества. Тут же потребитель может возразить, что некачественной воды быть не может. Ее допустили согласно ГОСТам и СанПинам к использованию, и значит какая-то там жесткость, является чуть ли не мифом. Да при работе с такой водой образовывается вредный налет. Но его вполне можно устранить своими силами, путем обычных чисток. На предприятиях не эффективные методы определения карбонатной жесткости воды оборачиваются в большие статьи расходов и там эта логика не работает.
При этом жесткость, как превышение определенной нормы по содержанию кальция и магния в воде, точнее их солей, может быть разной. И вред от такой воды тоже будет разниться. Разделение по видам известковости представлено в таблице.
Вид воды | Показатель (мг-экв/литр) |
Мягкая Слабо жесткая Жесткая Очень жесткая | До пяти От шести до семи До девятки Свыше девятки |
Все, что свыше показателя семерки может приносить вред и не малый. Способы умягчения воды на такие случаи как раз и разрабатывались.
К основным негативным последствиям жесткости относятся:
- Резкий рост расходов топлива и моющих средств и самой воды;
- Образование блокирующей тепло, накипи;
- Поломки оборудования;
- Негативное влияние на качество стирки
Можно ли спутать работу жесткости с другими примесями? На начальных стадиях, пока накипи еще нет или она очень тонкая, можно. Пока плотный осадок не образуется, известковость можно принять за изобилие хлорки в воде.
На крупных промышленных предприятиях, где производят питьевую воду или работают с водой постоянно, жесткость проявляет себя сразу. Есть правила, которые нельзя нарушать. Т.к. слой накипи в котле не должен превышать каких-то полмиллиметра. Откуда такие ограничения? Все это напрямую связано с особенностями известковости, как материала.
Когда она оседает на поверхность, то передача тепла в воду практически прекращается. Известь работает как эффективный блокиратор. И чем она плотнее, тем хуже передача тепла. Когда накипь достигает состояния гипса, передача тепла прекращается практически полностью. Правда, нагревательный элемент в этом случае перегорит раньше. Аспект в том, что энергия из металла никуда не уходит, она продолжает его накалять до тех времен, пока он не видоизменится. То есть либо не взорвется, либо не расплавится. В отраслях, с таких последствий и начинали долгий путь поисков подходящих способов умягчения воды.
Избежать всего этого букета можно, как известно, путем постоянных чисток и промывок, или же путем разработки и монтажа очистной системы. Первый вариант решения проблемы до сих пор применяют, но только там, где пока нет возможности установить прогрессивное умягчающее оборудование, или хотя бы просто умягчающее оборудование.
Чистки поверхностей обладают большой популярностью у населения. Точнее, даже у тех слоев, кто ими собственно не занимается, но считает, что они явно дешевле двух умягчающих приборов в квартиру. Но любая чистка углекислого газа с известковой водой оставит после себя следы. И щетка, и кислота отчищают вместе с накипью и поверхности. Из-за этого оборудование будет служить меньше, а чистки в дальнейшем только участятся.
Причем на предприятии, такие чистки выглядят как профилактические и капитальные. Последние проводятся не чаще двух раз за все время работы оборудования. Такая капитальная чистка подразумевает полную разборку оборудования. Особо загрязненные поверхности замачивают в кислотных растворах, там разрыхляются старые остатки и только потом производят механическую очистку. Причем этап замачивания может длиться несколько часов. Такие разборки означают простои и влекут за собой упущенную выгоду. С применением умягчающих установок, капитальные чистки уходят в прошлое. Даже при сильно жесткой воде, достаточно прополоскать систему обратным протоком воды, чтобы вынести легкие взвеси, в которые превращаются соли жесткости.
Способы умягчения жесткой воды – инструкция по применению
Чтобы не тратить огромные средства на очистки, не закупать постоянно растворы для умягчения воды или устранения накипи, были созданы различные эффективные и не эффективные способы умягчения жесткой воды. Их задача по-разному, но избавить воду от излишков солей жесткости. Если их устранить, то накипные отложения в воде образовываться не будут.
Сделать все это можно с помощью двух направлений. Можно воду умягчать, путем добавления в нее каких-то специальных, умягчающих средств, можно воду облучать. По этому принципу и все умягчающие установки сегодня делятся. Хочешь получить мягкую воду, создай какое-то новое вещество, которое не осядет на поверхности и легко отфильтруется, или же воздействуй на воду, какой-то естественной силой.
Реагентные умягчители в общем делятся на два вида. Это дезинфекторы, сильно схожие с дезинфекторами для обеззараживания, и катионные умягчители. Первые работают по простейшему принципу – добавляем в воду умягчитель, она становится мягче.
Вторые работают на обменном процессе. Заполняют обменный картридж катионной смолой. Следует рассмотреть ионный обмен, как метод умягчения воды, при чем весьма эффективный. В ней большое количество натрия. При контакте с солями жесткости, натрий и соли меняются местами. Потребителю поступает уже умягченная вода. Но вот картридж достаточно быстро придет в негодность. Натрий весь вымоется, и его нужно будет менять. В промышленных производственных процессах картриджи восстанавливают с помощью промывки сильно соляным раствором. При личном потреблении и производстве питьевой воды картридж меняют.
Когда его восстанавливают, образуются очень вредные отходы, которые мало того, что нужно почистить, нужно еще и разрешение получить, на то, чтобы их слить в атмосферу. Да и сами картриджи со временем придется менять. Такое умягчение при первичных малых вложениях, в дальнейшем оказывается недешевым. Но гарантирует хорошее качество непосредственно умягчения. Да и для повышения качества умягчения, можно воду прогнать через установку еще раз.
Дезинфектор подразумевает простое впрыскивание в воду специальных веществ, умягчающих воду. Такой прибор врезается в трубу. Есть у него блок управления, где задается частота, время и оббьем подачи умягчающих средств. Здесь же постоянно измеряют электропроводимость воды, с целью понять жесткая вода или нет. Контроль идет постоянно. Так влияние человеческого фактора снижается и значительно.
Вторая группа эффективных способов умягчения жесткой воды относится к безреагентным. Яркие представители от магнита до электрических импульсов. Больше всего сегодня применяют электромагниты. Маленькие, безпроблемные умягчители воды ионообменные гарантируют не только мягкую воду в системе. С их помощью можно избавиться от старых накипных следов в любом месте системы, совершенно не разбирая установки. Причем работать прибор будет экономно, всего каких-то пять киловатт в месяц электроэнергии. Сменных картриджей нет, следить за состоянием и обновлением не нужно. Правда качество питьевой воды такой прибор не дает, но для обслуживания всей воды в квартире или в котельной, например, просто незаменим.
Ограничения в его работе некоторые все же есть. Он не работает с водой без движения и не дает питьевого качества. Его эффект не держится долгое время.
Еще одна группа эффективных способов умягчения жесткой воды относится к тонкой очистке. Такие приборы устраняют из воды почти все примеси органического характера. К ним относится ультрафильтрация, обратный осмос, нанофильтрация. Основной удар в таких системах принимает на себя мембрана. Она самая дорогая в приборе и самая восприимчивая. Без подготовки воду через нее пропускать нельзя. Отсюда и дороговизна химического способа умягчения жесткой воды. Правда, такие устройства часто слишком много убирают из воды, что так же ограничивает, но не сильно их применение.
