формула, применение в очистке канализации
Химический состав
Гидроксид натрия или каустическая сода производится из густого раствора поваренной соли путем электролиза. В естественной среде не встречается, является продуктом химической промышленности, имеет формулу NaOH, указывающую на наличие в гидроксиде молекул натрия, кислорода и водорода в различном состоянии.
На фото изображена модель молекулы гидроксида натрия.
Список названий
В узкопрофильной литературе, информационных статьях и на этикетках товаров можно встретить синонимы названия:
- едкий натр;
- каустик;
- едкая щелочь;
- гидроокись натрия.
Основное имя щелочи подарили греки; согласно Большому Энциклопедическому словарю, kaustikos — «едкий», «жгучий», что в полной мере раскрывает свойства каустической соды и ее класс опасности.
Существует ничем не подтвержденный миф, что содой долгое время называлась зола растения с аналогичным именем, используемая древними представителями человеческой цивилизации для мытья и обезжиривания посуды. Якобы первыми уникальные свойства вещества заметили крестьяне и работники кухонь в больших поместьях Средневековой Европы.
До середины 18 века щелочами называли все разновидности соды, разделение на каустическую, кальцинированную и поташ произошло в 1736 году, благодаря работам француза А. Д. дю Мансо.
В наше время содой называют только соли угольной кислоты, то есть пищевую соду.
Промышленное использование каустика
Гидроокись натрия является самой распространенной щелочью, выпускается как в жидком виде, так и в форме мелких белых гранул, практически не имеющих собственного аромата. Каустическая сода поставляется на промышленные предприятия в цистернах или другой герметически упакованной таре, в зависимости от состояния и назначения.
Основными потребителями едкого натрия на сегодняшний день являются следующие области народного хозяйства:
- химическая – в производстве мыла, глицерина, водорода, в качестве реагента или катализатора для химических процессов, минеральных удобрений, бытовой химии.
- металлургическая – для работ, связанных с добычей алюминия, цинка и титана из смешанного вторсырья;
- автомобильная – каустическая сода применяется для очищения и мойки форм, используемых для выпуска автопокрышек;
- текстильная – с помощью раствора едкого натра обычные растительные волокна приобретают блеск и шелковистость;
- газовая и нефтяная – как катализатор при производстве биотоплива с отличными характеристиками;
- пищевая — производство карамели, шоколада, какао, газированных напитков, хлебобулочных изделий не обходится без участия гидроокиси натрия. Имеет собственное имя в бесконечном списке пищевых добавок – E524;
- бумажная промышленность – каустическая сода незаменима в превращении целлюлозы в бумагу и картон.
Полезные и вредные свойства гидроокиси натрия
Едкий натр замечательно справляется с жировыми отложениями на различных поверхностях, отлично смягчает воду, способна нейтрализовывать вредные вещества в воздухе и на поверхности, имеет низкую стоимость и общедоступность.
При всей своей востребованности щелочь относится к опасным химическим соединениям, применение каустической соды может сопровождаться следующими рисками:
- взаимодействуя с водой каустик, выделяет большое количество водорода и тепла, поэтому взрывоопасен;
- попадая на кожу, едкий натр способен привести к сильнейшим химическим ожогам, трудно поддающимся лечению. Контакт гидроокиси натрия с поверхностью глазного яблока, пусть даже кратковременный, может привести к потере зрения, попадание на слизистую – к некрозу тканей, воспалению легких, кровавой рвоте и диарее;
- обладает сильными коррозийными свойствами по отношению к эмалированным, оцинкованным и алюминиевым поверхностям.
Основные отличия кальцинированной соды и едкого натра
В первую очередь, это химическое строение молекул, что отражается в формуле каустика — NaOH — и кальцинированной соды – Na2CO3.
В-вторых – кальцинированная разновидность менее агрессивна и, как следствие, не имеет таких ярко выраженных реакций с водой, металлами и органическими загрязнениями.
В-третьих – она более безопасна как для человека, так и для окружающей среды.
Области использования гидроокиси натрия в быту
Каустическая сода, при внимательном и осторожном обращении, при соблюдении нехитрых правил безопасности является бесценным помощником в решении многих бытовых проблем.
Внимание! Перед началом работы наденьте прорезиненные перчатки, очки и плотную одежду. Для применения в быту разводите каустик только в эмалированной или пластиковой посуде, устойчивой к воздействию щелочей, при открытой форточке.
Борьба с канализационными засорами
В этой ипостаси соде каустической нет равных — использование вещества, согласно инструкции по применению, 1 раз в месяц не только прочистит трубы в кухне, ванной и туалете, но и поможет избавиться от запаха, появляющегося в помещении в результате органических отложений в канализации:
- Для очистки системы в частном доме следует залить 2 кг едкого натра 4 л обычной воды из-под крана и влить аккуратно раствор в раковину, унитаз или сливное отверстие душа (ванной). Заткнуть пробкой, через час влить полтора ведра очень горячей воды и использовать систему по назначению.
- Для борьбы с органикой в сифонах и стояках многоквартирных домов нужно засыпать в сливное отверстие порошок каустической соды в количестве 150 граммов и очень осторожно влить туда же несколько литров кипятка. Через четверть часа добавить еще столько же горячей воды, затем через десять минут влить уже около ведра воды, подогретой до 90 градусов. Пользоваться сливом можно только через час после завершения процедуры.
Каустическая сода входит в состав многочисленной армии средств по очистке канализационных систем, в том числе является действующим веществом в геле «Крот», так как превосходно растворяет волосы, попавшие в слив и являющиеся основной причиной засоров. Едкий натр продолжает свое воздействие на внутреннюю поверхность труб даже после многочисленных смываний, сглаживая шероховатости и неровности, задерживающие грязь и мелкие, нерастворимые частицы жидких бытовых отходов.
Самой эффективной для чистки канализации является каустическая сода в гранулах, однако и она плохо справляется с остатками земли, поэтому процедуру лучше проводить комплексно – сначала использовать кислотные средства, затем — едкую щелочь, которая заодно нейтрализует кислоту.
Приусадебное хозяйство
- Незаменима каустическая сода в проведении дезинфекции теплиц. После сбора урожая, садоводы обрабатывают раствором едкого натра стояки и поверхности закрытых площадей для выращивания ранней продукции, так как гидроокись натрия отлично убирает грибок и различные виды мелких паразитов, накапливающихся за период вегетации огурцов и помидоров.
- Особенно эффективна едкая щелочь для санитарной обработки хозяйственных построек, в которых содержались домашние животные. Такая процедура позволяет удалять болезнетворные бактерии и микробы с внутренних поверхностей сараев и коровников.
- Подойдет каустическая сода и для применения в быту – ею хорошо проводить дезинфекцию погребов перед сезонной закладкой овощей.
Меры предосторожности, необходимые при работе с едким натром
Следует внимательно читать инструкцию по применению на упаковке с гидроокисью натрия, которая не только подскажет, как развести каустическую соду, но и укажет необходимые пропорции с водой для той или иной цели.
В обязательном порядке нужно надевать прорезиненные перчатки, очки и специальную плотную одежду при использовании растворов едкой щелочи на больших площадях и в теплицах.
При работе с канализацией хватит очков и специальных рукавиц. Не допускать попадания ингредиентов или самого раствора на открытые участки кожи, а также на эмалированные или оцинкованные поверхности.
Первая помощь при ожоге, вызванном едкой щелочью
Держать пораженный участок под сильной струей холодной воды не менее 10-15 минут, затем промыть следующими растворами:
- борная кислота и вода в пропорции 1 ч. л:200мл;
- уксусная кислота и вода в соотношении 3:100.
Затем наложить на ожог бинт, пропитанный 5% раствором уксусной кислоты и немедленно отправиться в больницу.
Если пары или брызги растворов каустической соды попали на слизистую или в глаза, следует немедленно промыть их 2% борной кислотой, затем тщательно ополоснуть чистой водой и обратиться за помощью к врачу-специалисту.
Домашнее мыло и каустическая сода
Существует технология приготовления мыла в домашних условиях, позволяющая изготавливать красивые и полезные подарки своими руками. Налажено производство и сбыт специальной основы, не требующей больших временных затрат в приготовлении такого рода сувениров – растопил, добавил чего хочешь, разлил в формочки и все – оригинальный и приятный подарок готов. Однако стоят такие заготовки немало, да и непонятно из чего они производятся. Другое дело – приготовление мыла собственными руками с нуля. Основными ингредиентами для домашнего мыловаренного производства являются растительные и эфирные масла, дистиллированная вода и, конечно же, каустическая сода. Пропорции и состав у всех сортов кустарной продукции разные, постепенно каждый мыловар опытным путем находит свое, неповторимое сочетание, неизменным остается только использование едкого натра в таком увлекательном деле.
Внимание! Гидроокись натрия относится к опасным веществам второго класса, поэтому хранить ее нужно в плотной посуде и в местах, недоступных для детей.
Где можно приобрести каустическую соду
Продается щелочь в хозяйственных магазинах и в торговых точках, занимающихся реализацией сантехники, садоводческого инвентаря, строительных материалов. Для производства домашнего мыла каустическая сода высокой очистки распространяется в сети специальных магазинов и, конечно же, в Интернете.
Каустическая сода
Синонимы: Натр едкий, гидроксид натрия, гидрат окиси натрия, едкая щелочь, каустик.
Описание: Натр едкий технический (сода каустическая):
- Марка РД, (раствор диафрагменный) — бесцветная или окрашенная жидкость, получаемая диафрагменным методом, электролиза раствора поваренной соли, после которого электролизный щелок выпаривают до нужной концентрации, как правило 42-50%. Соответствует ГОСТ 2263-79 с изм.1,2
- Марка ТР, (твердый ртутный) — чешуированная масса белого цвета, сильно гигроскопична, хорошо растворима в соде и спирте. Стандарт GB209-2006, соответствует ГОСТ 2263-79.
Химические характеристики каустической соды
Химическая формула: NaOH
Сода каустическая (натр едкий) — это очень сильное химическое основание.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13).
При растворении в воде, либо при разбавлении водного раствора, а так же при взаимодействии с кислотами выделяется много тепла.
Натр едкий, взаимодействует с углекислым газом, присутствующим в воздухе, связывает его, в результате чего, со временем, образуется белый осадок — сода кальцинированная (Na2CO3)
Натр едкий активно реагирует с легкими металлами: алюминием, цинком, магнием, оловом и их сплавами, выделяя при этом большое количество водорода.
Натр едкий способен разрушать стекло и фарфор посредством выщелачивания силикатов (за счет взаимодействия с содержащимся в них диоксидом кремния), а также материалы органического происхождения бумагу, кожу, ткани и т.д.
Не вступает во взаимодействие с углеродистой сталью, хромо-никелевой сталью, полиэтилен, поливинилхлорид, а так же со многими резинно-техническими материалами.
Химические показатели каустической соды (таблица 1)
| № п/п | Наименование показателей | Марка ТР | Марка РД | |
| Высший сорт | Первый сорт | |||
| 1 | Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Бесцветная или окрашенная жидкость, допускается выкристаллизованный осадок | |
| 2 | Массовая доля гидроксида натрия, %, не менее | 98,5 | 46,0 | 44,0 |
| 3 | Массовая доля углекислого натрия, %, не более | 0,8 | 0,6 | 0,8 |
| 4 | Массовая доля хлористого натрия, %, не более | 0,05 | 3,0 | 3,8 |
| 5 | Массовая доля железа в пересчете на Fe2O3, %, не более | 0,004 | 0,007 | 0,02 |
| 6 | Массовая доля хлорноватокислого натрия, %, не более | 0,01 | 0,25 | 0,3 |
| 7 | Массовая доля ртути, %, не более | 0,0005 | — | — |
Физические характеристики каустической соды
Молекулярная масса: 39,997 г/моль
Температура кипения 44%-го раствора 140-142°С
Температура замерзания соды каустической жидкой, марки РД, 1 сорт, с концентрацией 44% равна +7°С. Зависимость точки замерзания каустической соды представлена на Рис. 1:
Плотность 44%-го раствора — 1,468 г/см3 . Плотности водных растворов каустической соды представлены на Рис.2:
Раствор каустической соды относится к сильным электролитам. Удельная электропроводность представлена на Рис.3:
Область применения каустической соды
Натр едкий широко применяется в химической, нефтехимической, газовой, металлургической, целлюлозно-бумажной, текстильной, пищевой промышленности и для бытовых нужд:
- На предприятиях пищевой промышленности (маслозаводы, молзаводы, масложиркомбинаты, ликеро-водочные, пивоваренные заводы и т.д): для мойки промышленного оборудования, трубопроводов из нержавеющей и углеродистой стали от жира и масляных веществ, органических остатков, для обезжиривания и обработки тары, инвентаря.
- В процессах водоподготовки: применяется для нейтрализации кислот и их окислов в воде.
- В строительстве: при производстве строительных материалов (газобетонов), а так же для укрепления (грунтов) оснований фундаментов зданий и сооружений.
- В мыловарении: Для омыления жиров при производстве мыла, шампуня и других моющих средств, натр едкий входит в состав поверхностно-активных веществ многих моющих средств.
- В целлюлозно-бумажной промышленност, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит. А так же для отбеливания тканей, льна.
- В нефтяной сфере натр едкий применяют для очистки нефти, нефтепродуктов. С его использованием производится масляная продукция.
- В быту: для промывки канализации, систем отопления (чугун, углеродистая сталь), помещений и т.п., там где необходимо растворить, удалить органические отложения, загрязнения, остатки.
- Для мойки и обеззараживания/дезинфекции животноводческих комплексов/помещений.
Класс опасности каустической соды
Едкий натр представляет собой едкое коррозийноактивное вещество. При попадании на кожу вызывает химические ожоги, а при длительном воздействии может вызывать язвы и экземы. Сильно действует на слизистые оболочки. Опасно попадание едкого натра в глаза.
В случае попадания в глаза или на кожу тщательно промыть водой.
Предельно допустимая концентрация аэрозоля едкого натра в воздухе рабочей зоны производственных помещений (ПДК) — 0,5 мг/м3.
При работе с натром едким, необходимо пользоваться индивидуальными средствами защиты: защитными очками, резиновыми перчатками и защитной одеждой.
Каустическая сода пожаро- и взрывобезопасна, относится к вредным веществам 2-го класса опасности по ГОСТ 12.1.007.
Номер ООН 1824
Упаковка, транспортировка и хранение каустической соды
Технический едкий натр транспортируют железнодорожным, автомобильным, водным транспортом в крытых транспортных средствах в упаковке и наливом в железнодорожных и автомобильных цистернах, полиэтиленовых контейнерах, канистрах, в соответствии с правилами перевозок грузов, действующими на данном виде транспорта.
Технический едкий натр, марки РД, залитый в специализированные контейнеры, транспортируют только автомобильным транспортом. Раствор технического едкого натра хранят в закрытых емкостях из материала, стойкого к щелочам. Специализированные контейнеры заполняют продуктом на 98 % их вместимости.
Перед заполнением продуктом канистры и специализированные контейнеры должны быть промыты.
Горловины специализированных контейнеров уплотняют резиновыми прокладками, изготовленными из кислотощелочестойкой резины средней твердости по ГОСТ 7338.
При хранении натра едкого, марки РД, необходимо соблюдения температурного режима в складских помещениях
Технический едкий натр, марки ТР, упакован в полипропиленовый мешок 25 кг, с полиэтиленовым вкладышем. Упакованный продукт хранят в складских неотапливаемых помещениях в штабелях, высотой до 3 метров.
Гарантийный срок хранения — один год со дня изготовления.
Сода каустическая
Сода каустическая поставляется следующих видов:- Мембранная каустическая сода (чешуированная / гранулированная)
- Марка ГР — гранулированная ртутная
- Марка ТР — твердая ртутная (чешуированная)
- Марка РД — раствор диафрагменный
- Марка ТД — твердая диафрагменная (плавленная)
- Марка РР — раствор ртутный
- Марка РХ — раствор химический
- Марка ГД — гранулированная диафрагменная (плавленная)
- Марка ЧДА — чистая для анализа
Сода каустическая применяется в химической, нефтехимической, целлюлозно-бумажной, медицинской, пищевой промышленности, цветной металлургии, текстильной промышленности, в производстве вискозного шелка и отбеливании тканей, в анилинокрасочной промышленности, в мыловарении, в производстве алюминия и металлического натрия, растворимого стекла, щелочных аккумуляторов, в процессах водоподготовки и других областях народного хозяйства.
В химической промышленности сода каустическая используется для производства органических красителей, синтетического фенола, глицерина, инсектицидов, различных химикатов и полупродуктов, лекарственных средств, пластмасс и др., для очистки нефти, нефтепродуктов и минеральных масел. В черной металлургии применяется для удаления серы из стали, в целлюлозно-бумажной — для обработки целлюлозы, бумажной массы.
Сода каустическая Китай
GB 209-2006 (чешуированная/гранулированная)
| Технические характеристики | Норма |
|---|---|
| Массовая доля гидроксида натрия, %, не менее | 98,0 |
| Массовая доля углекислого натрия, %, не более | 0,29 |
| Массовая доля хлористого натрия, %, не более | 0,01 |
| Массовая доля оксида железа, %, не более | 0,001 |
Сода каустическая (чешуированная/гранулированная) упаковывается полипропиленовые мешки с полиэтиленовым вкладышем вместимостью 25 кг.
Хранение:Сода каустическая (чешуированная/гранулированная) хранится в закрытых складских помещениях. Гарантийный срок хранения — один год со дня изготовления.
Сода каустическая чешуированная Россия
СТО 00203312-017-2011 марка ТР
| Технические характеристики | Норма |
|---|---|
| Внешний вид | чешуированная масса белого цвета. допускается слабая окраска |
| Массовая доля гидроксида натрия, %, не менее | 98,5 |
| Массовая доля карбоната натрия, %, не более | 0,8 |
| Массовая доля хлористого натрия, %, не более | 0,05 |
| Массовая доля железа, %, не более | 0,004 |
| Сумма массовых долей окислов железа и алюминия, %, не более | 0,02 |
| Массовая доля кремниевой кислоты в пересчете на диоксид кремния, %, не более | 0,02 |
| Массовая доля сульфата натрия, %, не более | 0,03 |
| Сумма массовых долей кальция и магния в пересчете на кальций, %, не более | 0,01 |
| Массовая доля хлората натрия, %, не более | 0,01 |
| Массовая доля тяжелых металлов осаждаемых сероводородом в пересчете на свинец, %, не более | 0,01 |
| Массовая доля ртути, %, не более | 0,0005 |
Сода каустическая марки ТР упаковывается в полипропиленовые мешки по 25 кг.
Хранение:Соду каустическую марки ТР хранят в складских неотапливаемых помещениях.Гарантийный срок хранения — один год со дня изготовления.
Сода каустическая гранулированная Россия
СТО 00203275-206-2007 (взамен ТУ 6-01-1306-85)
| Технические характеристики | Норма | ||
|---|---|---|---|
| Высший сорт | Первый сорт | ||
| Внешний вид | гранулы сферической или полусферической формы белого цвета, допускается слабая окраска | ||
| Массовая доля гидроокиси натрия, %, не менее | 99,5 | 99,0 | |
| Массовая доля углекислого натрия, %, не более | 0,50 | 1,00 | |
| Массовая доля натрия хлорида, %, не более | 0,005 | 0,01 | |
| Массовая доля сульфатов, %, не более | 0,005 | 0,005 | |
| Массовая доля железа в пересчете на оксид железа, %, не более | 0,0020 | 0,0040 | |
| Массовая доля ртути, % не более | 0,0001 | 0,0001 | |
Сода каустическая гранулированная упаковывается в мешки полипропиленовые с клапаном и полиэтиленовым вкладышем вместимостью по массе 25 кг на паллетах до 1000 кг и в контейнеры мягкие специализированные для сыпучих продуктов из полипропиленовой ткани типа МКР массой нетто не более 1000 кг.
Хранение:Сода каустическая гранулированная должна храниться в закрытых складских помещениях, исключающих попадание влаги, в штабелях на поддонах, настилах, решетках. Натр едкий, упакованный в полипропиленовые мешки с клапаном не допускается хранить в вертикальном положении. При хранении в отапливаемых складских помещениях мешки и транспортные пакеты с натром едким располагают на расстоянии не менее одного метра от отопительных приборов. Гарантийный срок хранения — один год с даты изготовления.
Сода каустическая раствор Россия
ГОСТ Р 55064-2012 марка РД
| Технические характеристики | Норма | |
|---|---|---|
| Высший сорт | Первый сорт | |
| Внешний вид | бесцветная или окрашенная жидкость. допускается выкристаллизованный осадок | |
| Массовая доля гидроксида натрия, %, не менее | 46,0 | 44,0 |
| Массовая доля карбоната натрия, %, не более | 0,6 | 0,8 |
| Массовая доля хлористого натрия, %, не более | 3,0 | 3,8 |
| Массовая доля железа, %, не более | 0,007 | 0,02 |
| Сумма массовых долей окислов железа и алюминия, %, не более | не нормируется | |
| Массовая доля кремниевой кислоты в пересчете на диоксид кремния, %, не более | не нормируется | |
| Массовая доля сульфата натрия, %, не более | не нормируется | |
| Сумма массовых долей кальция и магния в пересчете на кальций, %, не более | не нормируется | |
| Массовая доля хлората натрия, %, не более | 0,25 | 0,3 |
| Массовая доля тяжелых металлов осаждаемых сероводородом в пересчете на свинец, %, не более | не нормируется | |
| Массовая доля ртути, %, не более | не нормируется | |
Сода каустическая марки РД заливается в автоцистерны и в кубовые емкости массой 1500кг.
Хранение:Соду каустическую марки РД хранят в складских неотапливаемых помещениях.Гарантийный срок хранения — один год со дня изготовления.
Сода каустическая ЧДА
ГОСТ 4328-77 (Чистая для анализа)
| Технические характеристики | Норма |
|---|---|
| Массовая доля гидроксида натрия, %, не менее | 98,0 |
| Массовая доля углекислого натрия, %, не более | 1,0 |
| Массовая доля общего азота, %, не более | 0,0005 |
| Массовая доля кремнекислоты, %, не более | 0,002 |
| Массовая доля сульфатов, %, не более | 0,0050 |
| Массовая доля фосфатов, %, не более | 0,0030 |
| Массовая доля хлоридов, %, не более | 0,0050 |
| Массовая доля алюминия, %, не более | 0,0010 |
| Массовая доля железа, %, не более | 0,0010 |
| Массовая доля кальция и магния в пересчета на Mg, %, не более | 0,024 |
| Массовая доля калия, %, не более | не нормируется |
| Массовая доля тяжелых металлов, %, не более | 0,0010 |
| Массовая доля мышьяка, %, не более | не нормируется |
Сода каустическая (натрия гидроокись) ЧДА упаковывается в герметичные полиэтиленовые мешки по 25 кг.
Хранение:Соду каустическую (натрия гидроокись) ЧДА хранят в крытых и вентилируемых помещениях. Гарантийный срок хранения продукта — 6 месяцев со дня изготовления.
Транспортировка:
Соду каустическую транспортируют всеми видами транспорта в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта.
Техника безопасности:
Сода каустическая едкое вещество. Необходима защита кожи и глаз.
Выгодно
Низкие цены за счёт прямых контрактов с производителями
Надёжно
Работаем более 20 лет (с 1997 года) под одним ИНН.
Товар на складе
Более 3 000 тонн продукции в наличии на наших складах
Качество гарантируем
Работаем только с проверенными поставщиками.
Доставим как надо
Контролируем товар на всем пути
Сода каустическая — применение, производство, характеристики
Каустическая сода – это самая востребованная щелочь во всем мире. Еще ее называют гидроксидом натрия, едким натром, каустиком или едкой щелочью. Ежегодно для удовлетворения потребностей промышленности производится примерно 55,5 млн тонн этого вещества. Каустическую соду относят к категории сильных химических оснований, поскольку она полностью диссоциирует (растворяется) в воде.
Разновидности
По методу электролиза производят такие виды каустической соды:
- ртутная
- диафрагменная
- мембранная.
Некоторые различия производственного процесса дают возможность производить следующие марки:
- РР — раствор ртутный (первичный)
- ТР — твердый ртутный (чешуированный)
- РД — раствор диафрагменный 44-50%
- ТД — твердый диафрагменный (плавленый)
- РМ-В — раствор мембранный (первичный)
- РМ-Б — раствор мембранный 46-48%
- РМ-А — раствор мембранный 48-52%.
Характеристики
Химическая формула каустической соды — NaOH. Исходя из метода производства каустик бывает:
- твердая. Она представляет собой рассыпчатый белый порошок, не имеющий аромата и состоящий из чешуек или гранул. Ее удельная масса составляет 2,13 г/см3 при 20°С
- жидкая. Такая сода представляет собой бесцветный прозрачный раствор. Может наблюдаться небольшой осадок. Уровень концентрации составляет 44-50%. Раствор каустической соды имеет температуру кипения при атмосферном давлении 140-145°С, а замерзания +7 до +12°С.
Сода каустическая гранулированная имеет следующие особенности:
- токсична (ядовита)
- в жидком виде – летуча (испаряется)
- в твердом виде – гигроскопична (активно поглощает влагу из атмосферы).
Запомните, что нагревание гидроксида натрия может привести к взрыву.
Каустическая сода активно взаимодействует с материалами и химическими соединениями:
- приводит к разъеданию органические вещества (кожи, ткани, бумаги)
- реагирует с легкими металлами, алюминием, цинком, магнием, олово, а также с их сплавами
- приводит к разрушению фарфоровых и стеклянных предметов
- легко растворяется в глицерине, спиртовых растворах, к примеру, этаноле и метаноле
- вступает в реакцию нейтрализации с кислотой, вследствие чего образуется вода и соль.
Каустическая сода не реагирует:
- с металлическими сплавами, такими как хромо никелевая сталь или углеродистая сталь
- с синтетическими полимерами, такими как полиэтилен, поливинилхлорид
- практически со всеми резиновыми материалами
- с ацетоном, поскольку не растворяется в нем.
Стоит соблюдать осторожность при добавлении воды или кислоты к каустической соде, поскольку результатом реакции является выделение большого количества тепла.
Производство каустической соды
Получение каустической соды основано на процессе электролиза хлористого натрия. При этом в результате реакции выделяются хлор и водород.
Создать каустическую соду можно тремя методами:
- амальгамный (ртутный) метод
- диафрагменный метод
- мембранный метод
Амальгамный метод базируется на процессе электролиза, в котором используется ртутный катод. Главным достоинством метода является получение довольно чистого каустика, в котором нет хлора.
Диафрагменным методом можно получить каустик, в котором содержится много хлора. Однако, стоимость изготовления существенно ниже. Этот способ базируется на процессе разделения катода и анода пористой диафрагмой.
Мембранный метод называют самым перспективным. Метод основан на процессе разделения катода и анода мембраной, пропускающей исключительно ионы натрия. Главным достоинством можно назвать существенную простоту метода, в сравнении с диафрагменным методом. Кроме этого, данный метод наименее энергозатратет. Тратится на 25% меньше энергии, чем при ртутном методе и на 15% меньше, чем при диафрагменном. Этот способ является самым экологичным из всех перечисленных.
На территории России каустическую соду выпускают на 10 заводах. Главным образом используют ртутный и диафрагменный способы. Мембранной технологией может похвастаться лишь одно предприятие.
Для чего применяется каустическая сода
По статистике ежегодно в мире используется около 57 миллионов тонн данного соединения. Это достаточно большой объем. Каустическая сода, применение которой основано на ее уникальных свойствах, используется в:
- целлюлозно-бумажной отрасли во время делигнификации целлюлозы. Кроме этого, данное вещество применяется для создания картона, бумаги, древесно-волоконных плит, а также искусственных волокон
- производстве шампуня, мыла и моющих средств. Раствор каустической соды мыльный на ощупь. Этот факт был замечен еще много веков назад. Сегодня каустик часто используется в промышленной мойке
- химической промышленности. Здесь соду применяют для нейтрализации кислоты и кислотных окислов, отдавая ей роль катализатора или реагента. Также каустик задействован в изготовлении чистых металлов и для травления алюминия. В различных лабораториях он используется в процессе титрования
- производстве биодизельного горючего. Такое топливо создают из растительных масел и применяют в качестве альтернативного заменителя всем известного дизельного топлива. Для получения биодизельного топлива нужно прилить щелочного катализатора и одну массовую единицу спирта к девяти массовым единицам растительного масла. Вследствие этого получается эфир, характеризующийся прекрасными воспламеняющимися параметрами. Сырьем для такого типа топлива применяют самые разнообразные растительные масла, к примеру, соевое, рапсовое и другие. Исключением являются масла, в которых имеется пальмитиновая кислота
- прочистке канализационных труб от засоров и отложений. Все средства для прочищения канализационных труб, которые сегодня продаются в хозяйственных магазинах, создаются исключительно на базе гидроксида натрия
- в гражданской обороне. Каустическая сода может разрушить отравляющие вещества и убрать из вдыхаемого воздуха углекислый газ
- в приготовлении пищи. Примечательно, что в процессе изготовления пищи, гидроксид натрия применяют самым разным образом. Он используется в процессе чистки и мытья овощей и фруктов. Применяется он и в изготовлении какао, шоколада, мороженого, разных напитков. Каустическую соду применяют как краситель для карамели и оливок. Каустическая сода является пищевой добавкой Е-524
- косметологии. Обработка каустической содой ороговевших участков кожи приводит к обновлению кожного покрова. Также ею удаляют папилломы и бородавки.
Меры предосторожности
Так как каустическая сода представляет собой едкое и коррозийноактивное вещество, ее относят к категории второго класса опасности. Следовательно, соблюдение мер предосторожности является обязательным.
При попадании едкого натра на кожу, слизистую оболочку или в глаза, можно получить ожог. При попадании в глаза происходит атрофия зрительного нерва, которая может привести к полному лишению зрения.
Если каустическая сода попала на слизистую оболочку, то ее срочно нужно промыть большим количеством проточной воды. Учтите, что вода должна быть слегка теплая. Ни в коем случае нельзя промывать горячей водой.
Когда сода попадет на кожные покровы, их нужно протереть слабым раствором уксусной кислоты.
Людям, работающим с каустической содой, нужно обязательно иметь:
- специальные брызгозащитные очки
- перчатки, имеющие прорезиненную поверхность или простые резиновые перчатки
- прорезиненный костюм или пропитанную винилом химически-стойкую одежду.
Каустическая сода хорошо переносит транспортировку. Перевозка осуществляется различными методами – по железной дороге, по воде, а также автомобильным транспортом. Жидкую соду перевозят в цистернах, а в твердом виде ее перевозят в мешках. Поскольку гидроксид натрия хорошо и активно поглощает влагу, то во время перевозки его нужно оградить от попадания на него жидкости. Кроме этого, на вещество не должны попадать прямые солнечные лучи.
Срок годности едкого натра составляет не более 12 месяцев. Склад, на котором будет храниться каустик, не должен отапливаться.
Жидкий гидроксид натрия должен быть перелит в специальную щелочестойкую емкость, которая должна быть плотно закрыта. И жидкий и сухой каустик нужно хранить в сухом, прохладном помещении.
Гидроксид натрия — Википедия
Гидрокси́д на́трия (лат. Nátrii hydroxídum; другие названия — каустическая сода, едкий натр) — самая распространённая щёлочь, химическая формула NaOH. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Интересна история тривиальных названий как гидроксида натрия, так и других щелочей. Название «едкая щёлочь» обусловлено свойством разъедать кожу (вызывая сильные ожоги), бумагу и другие органические вещества. До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 году французский учёный Анри Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой, а карбонат калия — поташом. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Гидроксид натрия — белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
Термодинамика растворов
ΔH0 растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при +12,3…+61,8 °C кристаллизуется моногидрат (ромбическая сингония), температура плавления +65,1 °C; плотность 1,829 г/см³; ΔH0обр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация). Растворимость в метаноле 23,6 г/л (t = +28 °C), в этаноле 14,7 г/л (t = +28 °C). NaOH·3,5Н2О (температура плавления +15,5 °C).
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH, а также гидроксид одновалентного таллия TlOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.

Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
- с кислотами, амфотерными оксидами и гидроксидами
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
- NaOH+h3S→NaHS+h3O{\displaystyle {\mathsf {NaOH+H_{2}S\rightarrow NaHS+H_{2}O}}} (кислая соль, при отношении 1:1)
- 2NaOH+h3S→Na2S+2h3O{\displaystyle {\mathsf {2NaOH+H_{2}S\rightarrow Na_{2}S+2H_{2}O}}} (в избытке NaOH)
Общая реакция в ионном виде:
- OH−+H+→h3O{\displaystyle {\mathsf {OH^{-}+H^{+}\rightarrow H_{2}O}}}
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
- 2NaOH+ZnO →500−600oC Na2ZnO2+h3O{\displaystyle {\mathsf {2NaOH+ZnO\ {\xrightarrow[{}]{500-600^{o}C}}\ Na_{2}ZnO_{2}+H_{2}O}}}
- 2NaOH+ZnO+h3O→Na2[Zn(OH)4]{\displaystyle {\mathsf {2NaOH+ZnO+H_{2}O\rightarrow Na_{2}[Zn(OH)_{4}]}}} — в растворе
- с амфотерными гидроксидами
- NaOH+Al(OH)3 →1000oC NaAlO2+2h3O{\displaystyle {\mathsf {NaOH+Al(OH)_{3}\ {\xrightarrow {1000^{o}C}}\ NaAlO_{2}+2H_{2}O}}} — при сплавлении
- 3NaOH+Al(OH)3→Na3[Al(OH)6]{\displaystyle {\mathsf {3NaOH+Al(OH)_{3}\rightarrow Na_{3}[Al(OH)_{6}]}}} — в растворе
- с солями в растворе:
- 2NaOH+CuSO4→Cu(OH)2↓+Na2SO4{\displaystyle {\mathsf {2NaOH+CuSO_{4}\rightarrow Cu(OH)_{2}\!\downarrow +Na_{2}SO_{4}}}}
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
- c неметаллами:
например, с фосфором — с образованием гипофосфита натрия:
- 4P+3NaOH+3h3O→Ph4↑+3Nah3PO2{\displaystyle {\mathsf {4P+3NaOH+3H_{2}O\rightarrow PH_{3}\!\uparrow +3NaH_{2}PO_{2}}}}
с серой:
- 3S+6NaOH→2Na2S+Na2SO3+3h3O{\displaystyle {\mathsf {3S+6NaOH\rightarrow 2Na_{2}S+Na_{2}SO_{3}+3H_{2}O}}}
- с галогенами
- 2NaOH+Cl2→NaClO+NaCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaClO+NaCl+H_{2}O}}} (дисмутация хлора в разбавленном растворе при комнатной температуре)
- 6NaOH+3Cl2→NaClO3+5NaCl+3h3O{\displaystyle {\mathsf {6NaOH+3Cl_{2}\rightarrow NaClO_{3}+5NaCl+3H_{2}O}}} (дисмутация хлора при нагревании в концентрированном растворе)
- с металлами
Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксоалюмината натрия и водорода:
- 2Al+2NaOH+6h3O→2Na[Al(OH)4]+3h3↑{\displaystyle {\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}\!\uparrow }}}
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых (в том числе боевых) условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
- с эфирами, амидами и алкилгалогенидами (гидролиз):
с жирами (омыление) такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века.
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла в зависимости от состава жира.
- с многоатомными спиртами — с образованием алкоголятов:
- HOCh3Ch3OH+2NaOH→NaOCh3Ch3ONa+2h3O{\displaystyle {\mathsf {HOCH_{2}CH_{2}OH+2NaOH\rightarrow NaOCH_{2}CH_{2}ONa+2H_{2}O}}}
Качественное определение ионов натрия[править | править код]
 Атомы натрия придают пламени жёлтое свечение.
Атомы натрия придают пламени жёлтое свечение.- По цвету пламени горелки — атомы натрия придают пламени жёлтую окраску
- С использованием специфических реакций на ионы натрия
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро- лоновая кислота | Диокси- винная кислота | Бромбензол- сульфокислота | Ацетат уранила-цинка |
|---|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | жёлто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия[править | править код]
К химическим методам получения гидроксида натрия относятся пиролитический, известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Пиролитический метод[править | править код]
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия (например, в муфельной печи). В качестве сырья может быть использован и гидрокарбонат натрия, разлагающийся при нагревании на карбонат натрия, углекислый газ и воду:
- 2NaHCO3 →250oC Na2CO3+CO2↑+ h3O{\displaystyle {\mathsf {2NaHCO_{3}\ {\xrightarrow {250^{o}C}}\ Na_{2}CO_{3}+CO_{2}\!\uparrow +\ H_{2}O}}}
- Na2CO3 →1000oC Na2O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}\ {\xrightarrow {1000^{o}C}}\ Na_{2}O+CO_{2}\!\uparrow }}}
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
- Na2O+h3O→2NaOH{\displaystyle {\mathsf {Na_{2}O+H_{2}O\rightarrow 2NaOH}}}
Известковый метод[править | править код]
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашеной известью при температуре около 80 °С. Этот процесс называется каустификацией и проходит по реакции:
- Na2CO3+Ca(OH)2→2NaOH+CaCO3↓{\displaystyle {\mathsf {Na_{2}CO_{3}+Ca(OH)_{2}\rightarrow 2NaOH+CaCO_{3}\!\downarrow }}}
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он кристаллизуется.
Ферритный метод[править | править код]
Ферритный метод получения гидроксида натрия состоит из двух этапов:
- Na2CO3+Fe2O3→850oC2NaFeO2+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+Fe_{2}O_{3}{\xrightarrow {850^{o}C}}2NaFeO_{2}+CO_{2}\!\uparrow }}}
- 2NaFeO2+2h3O →H+ 2NaOH+Fe2O3⋅h3O↓{\displaystyle {\mathsf {2NaFeO_{2}+2H_{2}O\ {\xrightarrow {H^{+}}}\ 2NaOH+Fe_{2}O_{3}\cdot H_{2}O\!\downarrow }}}
Первая реакция представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 800 – 900°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спёк обрабатывают (выщелачивают) водой по второй реакции; получается раствор гидроксида натрия и осадок Fe2O3⋅{\displaystyle \cdot }nH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щёлочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твёрдый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия[править | править код]
Способ основан на электролизе растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
- 2NaCl+2h3O→h3↑+Cl2↑+2NaOH{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow H_{2}\!\uparrow +Cl_{2}\!\uparrow +2NaOH}}}
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора, % | 99 | 96 | 98,5 |
| Электроэнергия, кВт·ч | 3150 | 3260 | 2520 |
| Концентрация NaOH, % | 50 | 12 | 35 |
| Чистота хлора, % | 99,2 | 98 | 99,3 |
| Чистота водорода, % | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl− в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом.
Диафрагменный метод[править | править код]
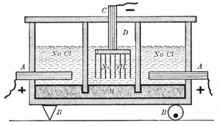 Схема старинного диафрагменного электролизера для получения хлора и щёлоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагма
Схема старинного диафрагменного электролизера для получения хлора и щёлоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагмаНаиболее простым из электрохимических методов в плане организации процесса и конструкционных материалов для электролизера является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подаётся в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку, направленному из анодного пространства в катодное через пористую диафрагму, становится возможным раздельное получение щёлоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH— ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO—), который затем может окисляться на аноде до хлорат-иона ClO3—. Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе получения гидроксида натрия. Также вредит и выделение кислорода, которое, к тому же, ведёт к разрушению анодов и, если они из углеродных материалов, попаданию в хлор примесей фосгена.
- Анод:
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\!\rightarrow Cl_{2}\!+2e^{-}}}} — основной процесс
- 2h3O→O2+4H++4e−{\displaystyle {\mathsf {2H_{2}O\rightarrow O_{2}+4H^{+}\!+4e^{-}}}}
- 6ClO3−+3h3O→2ClO3−+4Cl−+1.5O2↑+ 6H++6e−{\displaystyle {\mathsf {6ClO_{3}^{-}\!+3H_{2}O\rightarrow 2ClO_{3}^{-}+4Cl^{-}\!+1.5O_{2}\!\uparrow \!+\ 6H^{+}\!+6e^{-}}}}
- Катод:
- 2h3O+
Каустическая сода: применение для чистки канализации
Каустическая сода, каустик, натр едкий – это альтернативные названия гидроксида натрия, представляющего собой активную щелочь. Выпускается в виде белого мелкокристаллического порошка или готового водного раствора.
Обладает способностью разъедать различные загрязнения, поэтому широко используется в быту. Ей можно почистить металлические и эмалевые поверхности, обезжирить инструменты и даже мыть посуду.
Но наиболее частое применение реагент получил для прочистки канализационных засоров. Он способен быстро разъедать органические вещества на 100 % (волосы, остатки еды, белковые и жировые отложения, закупоривающие трубы) и обладает мощным пробивным действием. Каустическая сода нейтрализует шероховатости во внутренних частях труб, что снижает скорость отложения загрязнений в них.
Реагент используется и для нейтрализации кислотных стоков в трубопроводе, чтобы предотвратить их разрушающее действие на металл. Также им промывают канализацию после «ударной волны», чтобы удалить рыхлую грязь. Едкий натр эффективно разъедает твердые загрязнения и очищает трубы от накопившихся отложений.
Каустик достаточно использовать 1-2 раза в месяц в профилактических целях для отсутствия проблем с эксплуатацией канализации. Он является простым в применении и при этом недорогим средством. Может применяться для чистки всей канализационной системы.
Избавление от засоров с помощью раствора едкого натра
В первую очередь, необходимо рассчитать количество реагента, которое потребуется для чистки канализации. Оно будет зависеть от того, где планируется проводить процедуру: в квартире или в частном доме. В первом случае потребуется 2 кг каустика и 7 л воды (достаточно однократной прочистки). Во втором варианте нужно взять 3 кг каустической соды и 7л воды, процедуру провести дважды.
Если был выбран едкий натр в жидком виде, он уже готов к применению, и никаких дополнительных приготовлений не требуется. Для разведения сухого реагента нужно подготовить прочное пластиковое ведро объемом 10-12 л, пластиковый черпак, а также резиновые перчатки, маску и защитные очки (щелочь разъедает кожные покровы и слизистые оболочки, вызывая серьезные химические ожоги). Помещение, в котором будут проводиться работы, необходимо хорошо проветривать из-за летучести и токсичности каустика.
Очень важным является тот факт, что реагентом можно прочищать только стальной или чугунный трубопровод. Пластиковые трубы, либо другие элементы, выполненные из пластика, могут быть сильно повреждены щелочью.
Для прочищения трубопровода следует насыпать черпаком нужное количество порошка в ведро, налить холодную воду (так как щелочь растворяется в воде с выделением большого количества тепла, низкие температуры жидкости не позволят раствору кипеть и разбрызгиваться) и перемешать до полного растворения реагента. Затем раствор аккуратно заливается в трубу и выдерживается от 3 до 6 часов, после чего нужно включить воду на 10-15 минут для промывки канализации.
Прочищаем засор сухим порошком
Если по каким-то причинам раствор сделать не получается, можно воспользоваться и сухим каустиком. В таком случае реакция будет проходить уже в самих трубах, поэтому такой метод более агрессивный. Но эффект от обоих способов примерно одинаковый.
Чтобы чистить канализацию таким методом, необходимо влить 3 л горячей воды в сливное отверстие, засыпать туда 3 столовых ложки порошка (или 5-6 при сильном засоре), избегая его попадания на сантехнику, кафель и другие поверхности. Затем влить стакан воды и оставить на 3 часа, после чего промыть большим количеством жидкости.
При данном методе также следует использовать средства индивидуальной защиты. Таким образом, каустическая сода при правильном применении поможет быстро избавиться от засоров и наладить работу канализации.
Где купить?
Компания «АКВАХИМ» реализует высококачественную химпродукцию по самым доступным ценам. Для заказа просто нажмите на соответствующую кнопку возле фотографии товара и введите ваши контакты.
