Экспериментальное исследование: «Осмос на кухне»
Введение
Почему срезанная ветка при погружении ее в воду
оживает? Какие силы заставляют влагу проникать в
растение и двигаться внутри него? Что удерживает
воду в клетках и не даёт ей выходить наружу?
Каким образом клетка растения оказывается
проницаемой для воды только в одном направлении:
снаружи — внутрь? Учёные очень давно пытались
ответить на эти вопросы, но определённой ясности
удалось добиться только в конце Х1Х века. Прошло
ещё некоторое время, и в лабораториях сумели
смоделировать (хотя и очень грубо) это
таинственное природное явление. И это явление,
при котором наблюдается одностороннее
проникновение растворителя через
полупроницаемую мембрану, отделяющую раствор от
чистого растворителя, называется осмосом.
Несомненно, что первым растворителем на земле
явилась сама природа. Попробуй-ка с этим
поспорить, если первую же свою травинку природа
сумела напоить таким способом, который сегодня
дал толчок возникновению нового метода
опреснения. Что же это за таинственный метод,
патент на который природа получила миллионы лет
назад? Всё живое пользуется этим методом. И не
мудрено — ведь без осмоса невозможно утолить
жажду ни человеку, ни растению! Что значит хотеть
пить?! Это значит, что клеткам нашего организма не
хватает воды.
А уже в наши дни успехи исследования осмоса заставили работать клетки в самых разных областях науки и техники.
Слово “осмос” имеет греческое происхождение и означает толчок, давление. Уникальные свойства живых организмов, которые позволяют их клеткам избирательно поглощать и переносить различные вещества, стали предметом исследования многих учёных. Им удалось создать синтетические плёнки — так называемые мембраны, непроницаемые для одних веществ и “прозрачные” для других. После этого такие “совершенные фильтры” начали завоёвывать самые разные области науки и техники. С их помощью очищают газы и нефтепродукты, опресняют морскую воду, обрабатывают молоко и фруктовые соки, производят лекарства и витамины и делают ещё многое — многое другое. Интерес исследователей к данной теме продиктован актуальностью вынесенной в заглавие проблемы. Целью настоящей работы было - изучить явление осмоса, смоделировать его и подтвердить на опытах гипотезу, что жизнь без осмоса невозможна, так как питательные вещества поступают в организм благодаря осмотическому давлению. Осмос, на взгляд исследователей, имеет большое значение для растительных и животных организмов, способствуя достаточному обводнению клеток и межклеточных структур.
Методы, используемые в работе:
1) описательный метод,
2) метод наблюдения,
3) экспериментальный метод.
Объяснение осмоса
Собрались однажды математики на охоту. Но прежде чем отправиться в путь, они решили все обсудить. Вопрос стоял перед ними нешуточный: как поймать льва? Было над чем голову поломать.
Долго думали математики. Но вот, наконец, самый молодой из них произнес нижеследующее:
“Поймать льва — это так просто! Известно, что есть пустыня. Известно, что в пустыне имеется лев. Предположим, что существует полупроницаемая мембрана, которая пропускает через себя всё, кроме льва. Натягиваем мембрану поперёк пустыни — льва сдаём в зоопарк”.
Шутка математиков оказалась для водоснабженцев делом серьезным. Вооружившись полупроницаемыми мембранами, они тоже устроили охоту. Но ловили они не львов, а… соли. Соли, которые находятся в воде.
Чем пресная вода отличается от соленой?
В солёной воде, кроме молекул воды, находятся еще соли. Поэтому молекул воды в стакане с пресной водой больше, чем в стакане с солёной - часть объема в солёной воде занимает соль.
Посмотрим через микроскоп на пылинку в капле пресной воды и мы увидим, что она не стоит на месте — её двигают молекулы воды, которые находятся в постоянном движении.
Если мы поставим между пресной и солёной водой полупроницаемую мембрану (искусственную или сделанную из морковки — всё равно), то молекулы воды будут ударяться в неё чаще со стороны пресной воды, поскольку там их больше, ведь молекул солей там нет, и всё место занимают молекулы пресной воды.
Давление со стороны пресной воды возрастёт, и молекулы воды начнут переходить из пресной воды в солёную. Получается осмос.
Осмос — (от греч. “толчок”, “давление”),
односторонняя диффузия растворителя через
полупроницаемую перегородку (мембрану),
обусловленная стремлением системы к
термодинамическому равновесию и выравниванию
концентрации растворов по обе стороны мембраны.
Характеризуется осмотическим давлением. Это мы
можем увидеть прямо сейчас, рассмотрев этот
наглядный пример…
Вспомним, что происходит при растворении какого-нибудь вещества в растворителе. Молекулы вещества проникают в растворитель, а молекулы растворителя — в область, занятую раствором. Такая взаимная диффузия (проникновение) и приводит к выравниванию концентраций растворённого вещества и растворителя по всему объёму. Теперь представим себе ситуацию, при которой раствор и чистый растворитель разделены полупроницаемой перегородкой — она пропускает молекулы растворителя, но не пропускает молекулы растворённого вещества. Очевидно, что в этом случае выравнивание концентраций может происходить только за счёт односторонней диффузии растворителя. Молекулы растворителя будут перемещаться через мембрану из менее концентрированного раствора в более концентрированный, вызывая в последнем повышение уровня жидкости. Другими словами можно сказать, что растворитель проникает в раствор под действием сил так называемого осмотического давления. Как только гидростатическое давление столба уравновесит осмотическое давление, процесс прекратится.
Полупроницаемая мембрана
Полупроницаемой мембраной называется плёнка, пропускающая молекулы растворителя и не пропускающая молекулы растворённого вещества. Такую мембрану можно вырастить самому. Для этого в раствор медного купороса нужно бросить кристаллик жёлтой кровяной соли. Кристаллик должен быть чистым — лучше всего его отколоть от большого кристалла перед самым опытом. В результате поверхность кристаллика покрывается полупроницаемой мембраной. Вода проникает через неё и вызывает рост “клетки”. Оболочка “клетки” расширяется, а в тех местах, где плёнка лопается под действием внутреннего давления, сразу же снова образуется полупроницаемая оболочка. Так происходит снова и снова. Таким образом “клетка” постепенно принимает ветвистую форму. Этот классический опыт требует терпения и аккуратности, красивые “растения” с первой попытки могут и не получиться.
Процессы разделения жидких систем играют важную роль во многих отраслях народного хозяйства. Для осуществления этих процессов уже давно применяют разнообразные способы: перегонку и ректификацию, абсорбцию и адсорбцию, экстракцию и др. Однако природа за миллионы лет эволюции живых организмов выработала наиболее универсальный и совершенный метод разделения с использованием полупроницаемых мембран. Действительно, биологические мембраны обеспечивают направленный перенос необходимых организму веществ из внешней среды в клетку, и наоборот. Без мембран невозможны были бы дыхание, кроветворение, синтез белка, усвоение пищи, удаление отходов и другие процессы.
Учёные давно стремились познать и обратить на пользу человека замечательное свойство полупроницаемых мембран — пропускать одни вещества и задерживать другие. Однако идея применения мембран для технологических целей стала реальной лишь в последнее время в связи с развитием наших знаний о природе и структуре веществ, с новыми достижениями в различных областях науки, а также в производстве синтетических полимерных материалов.
Обратный осмос
А что, если надавить на соленую воду так, чтобы она под давлением, превышающим осмотическое, двигалась в сторону пресной воды? Что тогда произойдет? Тогда получится “обратный осмос”, и из соленой воды через мембрану будет выжиматься пресная.
В случае, когда на раствор с большей концентрацией воздействует внешнее давление, превышающее осмотическое, молекулы растворителя начнут двигаться через полупроницаемую мембрану в обратном направлении, то есть из более концентрированного раствора в менее. Этот процесс называется “обратным осмосом”. По этому принципу и работают все мембраны обратного осмоса. В процессе обратного осмоса растворитель и растворённые в нём вещества разделяются на молекулярном уровне, при этом с одной стороны мембраны накапливается практически идеально чистый растворитель, а все загрязнения остаются по другую её сторону. Таким образом, обратный осмос обеспечивает гораздо более высокую степень очистки. На практике, мембрана не полностью задерживает растворённые в растворителе вещества. Они проникают через мембрану, но в ничтожно малых количествах.
Поэтому очищенный растворитель все-таки содержит незначительное количество растворённых веществ. Важно, что повышение давления на входе не приводит к росту содержания солей в растворителе после мембраны. Наоборот, большее давление растворителя не только увеличивает производительность мембраны, но и улучшает качество очистки. Другими словами, чем выше давление растворителя на мембране, тем больше чистого растворителя лучшего качества можно получить.
Экспериментальное исследование
Осмос на кухне
Как выпитый глоток воды попадает в клетки нашего организма?
Отгадка, как и большинство научных открытий, будет базироваться на теории и научном эксперименте. Эксперимент ставится на кухне и включает в себя три опыта.
Все опыты посвящаются одному явлению природы — осмосу. Теоретические выкладки занимают три предложения.
Теория в трех предложениях
Если два раствора разной концентрации разделить перегородкой, пропускающей молекулы воды, но задерживающей молекулы растворенного в ней вещества, то молекулы воды будут переходить в более концентрированный раствор, все больше и больше разбавляя его.
Так распорядилась природа. Люди назвали это явление — “осмос”.
Нами была проведена практическая работа, целью которой было определение закономерностей изменения осмотического давления. Я подтверждала свои гипотезы с помощью опытов.
У нас возникло несколько вариантов насчёт того что, от чего зависит осмотическое давление:
- от рода растворяемого вещества;
- от температуры раствора.
Опыт первый, или плачущий лимон (смотреть рисунок №1)
Взяли лимон и порезали его на тонкие дольки. Если нож острый, то сока при этом почти не получится. Но посыплем лимонные дольки сахаром— и понаблюдаем: спустя некоторое время из долек, как по волшебству, потечет сок.
Конечно, это никакое не волшебство. Просто тут начал действовать осмос: сок потек из лимона наружу, как бы стремясь как можно сильнее разбавить образовавшийся на его поверхности концентрированный раствор сахара.
А если мама когда-нибудь солила капусту (и мы, конечно, при этом присутствовали!), то должны были заметить следующий факт: после того как нашинкованную капусту перетрут с солью, ее объем резко уменьшается, а сама капуста становится влажной. Мама говорит: капуста пустила сок. А мы теперь можем сказать: это осмос. Ведь неважно, какое растворимое в воде вещество находится снаружи: клетки — сахар или соль.
Опыт второй, или своенравная картошка (смотреть рисунок №2)
Мы вырезали из сырой картошки три одинаковых кубика и каждый из них опустили в банку с водой, но только в одной банке воду слегка подсолили, в другой растворили как можно больше соли, а в третью — ничего не добавляли.
Спустя час-два заметили, что кубики стали различаться: первый из них (тот, что был в слабо соленой воде) остался прежнего размера,
второй (он находился в сильно соленой воде) съежился и стал значительно меньше, а третий, наоборот, разбух.
Стало понятно, что и тут сработал осмос. Первый кубик находился в слабом соляном растворе — его концентрация была примерно равна концентрации солей в картофельном соке. Второй кубик окружал раствор большей концентрации, чем концентрация солей в его собственном соке, и в результате осмоса кубик начал обезвоживаться и уменьшаться в размерах. Ну, а кубик, оставленный в водопроводной воде? С ним произошла обратная история: концентрация солей в его соке была выше, чем в воде, и вода начала переходить в кубик. Вот он и “вырос”!
Опыт третий, или морковка-насос (смотреть рисунок №3)
Взяли морковку. Самую обыкновенную. Отрезали от нее зеленый хвостик, а вместо него вставили стеклянную трубку. Получилась пика: морковка — наконечник, а трубка — древко. Если налить в трубку соленую морскую воду, а морковку поставить в стакан с водопроводной водой, то спустя некоторое время можно заметить, что уровень воды в трубке начинает ползти вверх. Это тоже осмос.
А знаете, с какой силой водопроводная вода будет давить на морковку? Она будет давить с такой силой, что сможет уравновесить столб воды высотой добрых десять метров. Такое давление называется осмотическим.
Отгадки
Когда морковка находится не в стакане с водой, а растет на огороде, то вода попадает в ее ткани точно так же. Ведь в ее соке концентрация солей выше, чем в воде, которой поливают огород.
Когда мы пьем, вода проникает в наш организм через стенки желудка благодаря осмосу – концентрация солей в крови выше, чем в воде, вот вода и просачивается в кровь.
Когда хозяйка варит суп, она солит воду сразу, чтобы из мяса и овощей вышло как можно больше сока. Но если нам надо приготовить отварное мясо, то следует его варить сначала в несоленой воде, чтобы сок не вышел.
XuMuK.ru — ОСМОС — Химическая энциклопедия
ОСМОТИЧЕСКОЕ
ДАВЛЕНИЕ ВОДНЫХ РАСТВОРОВ САХАРОЗЫ ПРИ 30 °С
Эксперим. данные |
Расчет по ур-иию
Ван Лаара |
Расчет по ур-нню
Вант-Гоффа |
|||
Для разб. р-ров электролитов
ур-ние Вант-Гоффа имеет вид:
где i= 1 + a'(v
— 1) (a’-степень диссоциации электролита, v-число ионов, на к-рые распадается
молекула электролита). В случае сильных электролитов, полностью диссоциирующих
на ионы, при высоких разбавлениях =
vc2RT, для р-ра произвольной концентрации =
vФc2RT, где Ф-практич. осмотич. коэффициент. Он непосредственно
связан с коэф. активности растворенного в-ва и моляль-ностью m р-ра электролита соотношением Бьеррума:
В интегральной форме соотношение
(8) принимает вид:
Это соотношение используют
для расчета Ф по данным о ; можно рассчитать Ф и по значениям .
Наиб. существ. черта всех
осмотич. процессов — увеличение объема р-ра. Оно всегда имеет место, если молекулы
растворенного в-ва не могут выйти из р-ра, а р-ритель способен проникать в р-р.
Это условие можно выполнить даже при отсутствии видимой полупроницаемой перегородки.
Напр., если фазы и содержат
нелетучий компонент и не разделены перегородкой, а находятся под одним колпаком,
из-под к-рого откачан воздух, то за счет разности давлений насыщ. пара произойдет
«перекачка» р-рителя из р-ра в р-р .
Такой процесс получил назв. изотермич. перегонки. Др. примером типичного проявления
осмоса без наличия полупроницаемой перегородки является набухание в системах
полимер-р-ритель.
Осмос в природе. Животные
и растит. клетки представляют собой микроскопич. осмотич. системы, поскольку
у клетки оболочка или прилегающая к ней плазмолемма обладают св-вами полупроницаемых
мембран. Если поместить клетки в дистиллированную воду, происходит набухание,
а затем разрыв оболочек (осмотич. шок, или лизис). В р-рах с высокой концентрацией
солей наблюдается падение осмотич. давления и коллапс клеток из-за потери воды
(плазмолиз). Это явление используют, напр., при консервировании пищ. продуктов
путем добавления больших кол-в соли или сахара: микроорганизмы подвергаются
плазмолизу и становятся нежизнедеятельными.
Р-ры с одинаковым значением
осмотич. давления наз. изотоническими. Р-ры с осмотич. давлением, большим, чем
у внутриклеточной жидкости, наз. гипертоническими, меньшим-гипотоническими.
Один и тот же р-р для одного типа клеток м. б. гипертоническим, для другого-изотоническим,
для третьего-гипотоническим.
В тканях растений осмотич.
давление составляет 0,5-2 МПа (у растений в пустынях — более 10 МПа). Гидро-статич.
давление, возникшее во внутриклеточных структурах в результате осмоса, наз.
тургором. Это давление придает прочность и упругость тканям живых организмов.
Если клетка отмирает, оболочка теряет св-во полупроницаемости, тургор исчезает
(растение вянет). Осмотич. давление-главная причина, обеспечивающая движение
воды в растениях и ее подъем от корней до вершины. Клетки листьев, теряя воду,
осмотически всасывают ее из клеток стебля, а последний-из клеток корня, берущих,
в свою очередь, воду из почвы. Для роста и развития растений важно соотношение
между осмотич. давлением почвенного р-ра и клеточного сока. Растение может нормально
развиваться лишь тогда, когда осмотич. давление клеточного сока больше осмотич.
давления почвенного р-ра.
Высокоорганизованные животные
и человек отличаются постоянным значением осмотич. давления, напр. в крови человека = 0,78
МПа (7,7 атм) при 37 °С. Даже небольшие изменения осмотич. давления вызывают
чувство дискомфорта. Так, чувство жажды обусловлено потребностью организма восстановить
нормальное осмотич. давление введением воды, после того как оно было повышено,
напр. употреблением соленой пищи. При болезненных явлениях локальные изменения
осмотич. давления м. б. значительными. Напр., при воспалит. процессах происходит
распад белков, что приводит к увеличению кол-ва структурных частиц в очаге воспаления,
повышению осмотич. давления и локальному оттоку воды из окружающих тканей. Так
возникают отеки.
В медицине обычно используют
изотонич. р-ры, но иногда применяют и гипертонические. Так, в хирургии гипертонич.
повязками покрывают раны: гипертонич. повязка оттягивает на себя жидкость и
очищает рану от микроорганизмов, продуктов распада и т.д.
Лит.: Горшков В.
И., Кузнецов И. А., Физическая химия, М., 1986; Дуров В. А., Агеев Е.П., Термодинамическая
теория растворов неэлектролитов, М., 1987. См. также лит. при ст. Мембранные
процессы разделения.
Е. П. Агеев.
© ХиМиК.ру
Роль осмоса в биологических процессах
Осмос имеет большое значение в жизнедеятельности человека, животных и растительных организмов. Как известно, все биологические ткани состоят из клеток, внутри которых находится жидкость (цитоплазма), представляющая собой раствор различных веществ в Н2О. Оболочка клетки полупроницаема и через нее достаточно свободно проходит вода.
Ионы электролитов и молекулы других веществ оболочка пропускает строго избирательно.
Снаружи клетки омываются межклеточной жидкостью, тоже представляющей собой водный раствор. Причем концентрация растворенных веществ внутри клеток больше чем в межклеточной жидкости. Вследствие осмоса наблюдается переход растворителя из внешней среды в клетку, что вызывает ее частичное набухание или тургор. При этом клетка приобретает соответствующую упругость и эластичность. Тургор способствует сохранению определенной формы органов у животных организмов, стеблей и листьев у растений. В срезанных растениях в результате испарения воды объем меж- и внутриклеточной жидкости уменьшается, снижается осмотическое давление, упругость клеток понижается и растение вянет. Увлажнение растений, помещение их в воду вызывает осмос и снова сообщает тканям упругость.
Кровь, лимфа, тканевые жидкости человека представляют собой водные растворы молекул и ионов многих веществ и обладают вследствие этого определенным осмотическим давлением. Причем на протяжении всей жизни организма биологические жидкости сохраняют свое давление на постоянном уровне независимо от состояния внешней среды. Это явление называется иначе изоосмией человеческого организма и является составной частью более общего процесса – гомеостаза или постоянства ряда физико-химических показателей внутренней среды человека в изменяющихся внешних условиях.
Изоосмия особенно присуща таким биологическим жидкостям как кровь и лимфа. Так осмотическое давление крови у человека практически постоянно и при 37оС изменяется в пределах 740-780 кПа (т.е., почти в 8 раз больше атмосферного).
Осмотическое давление крови у разных живых организмов неодинаково. Так у лягушек оно ниже, чем у человека, а у некоторых морских животных, наоборот, больше.
При изменении осмотического давления крови организм стремится восстановить его, удалив из крови избыточное количество растворенных частиц (если давление повышается) или, наоборот, увеличивая число кинетически активных частиц (если давление понижается). Основную роль в регуляции осмотического давления крови играют почки. В меньшей степени в сохранении изоосмии участвуют ткани печени и подкожной клетчатки. Они способны накапливать избыточные количества солей. При поражении почек вклад подкожной клетчатки в поддержание осмотического давления резко увеличивается. Содержание солей в ее клетках возрастает, что приводит вследствие осмоса к значительному увеличению объема клеток и появлению отечности.
Изоосмия регулируется, прежде всего, центральной нервной системой и деятельностью желез внутренней секреции.
Отклонение осмотического давления крови от нормы вызывает болезненное состояние. Так при его понижении наблюдается рвота, судороги, затемнение сознания. Повышение осмотического давления сопровождается отечностью, нарушением сердечной деятельности.
В некоторых случаях изменение осмотического давления в ограниченных участках тканей могут быть довольно большими. Так при локальных воспалительных процессах белковые молекулы в клетках распадаются на массу более мелких фрагментов, увеличивая тем самым число растворенных частиц в них. Вода из окружающих тканей и сосудов устремляется в эти клетки и значительно увеличивает их объем. При этом в районе воспалительного очага возникает опухоль. При ее разрезе или проколе гнойная жидкость вытекает из нее под большим давлением.
Растворы, осмотическое давление которых равно осмотическому давлению раствора принятого за стандарт, называются изотоническими.В медицине осмотическое давление растворов сравнивают с осмотическим давлением крови. Изотоническими по отношению к крови являются 0,9% (0,15 М) растворNaClи 4,5-5% раствор глюкозы. В этих растворах концентрация частиц растворенного вещества такая же, как и в плазме крови. Отличие состоит лишь в том, что в состав крови входит не толькоNaClили глюкоза, но и целый ряд других веществ. Их суммарная концентрация носит названиеосмолярности(изотонической концентрации) и представляет собой химическое количество всех кинетически активных (т.е., способных к самостоятельному движению) частиц (независимо от их формы, размеров и природы), содержащихся в 1 литре плазмы крови.
Осмолярная концентрация крови у человека составляет 0,287-0,303 моль/л.
Изотонические растворы NaClи глюкозы называют частофизиологическими растворами. Хотя в настоящее время этот термин для них признан неудачным, т.к. строго говоря, истинным физиологическим раствором является раствор по своему количественному и качественному составу максимально приближенный к плазме крови.
Растворы, обладающие более высоким осмотическим давлением, чем плазма крови, называются гипертоническими, а растворы, имеющие более низкое давление – гипотоническими.
При различных лечебных процедурах в кровь человека в больших количествах следует вводить только изотонические растворы, чтобы не вызвать осмотический конфликт из-за резкого несоответствия между осмотическим давлением биологической жидкости и вводимого раствора.
При контакте клетки с гипертоническим раствором происходит отток воды из клетки через мембрану в окружающую среду. Клетка при этом теряет свою упругость, вследствие обезвоживания и уменьшается в объеме (сморщивается).Нормальное течение физических и химических процессов в ней нарушается (рис. 25).
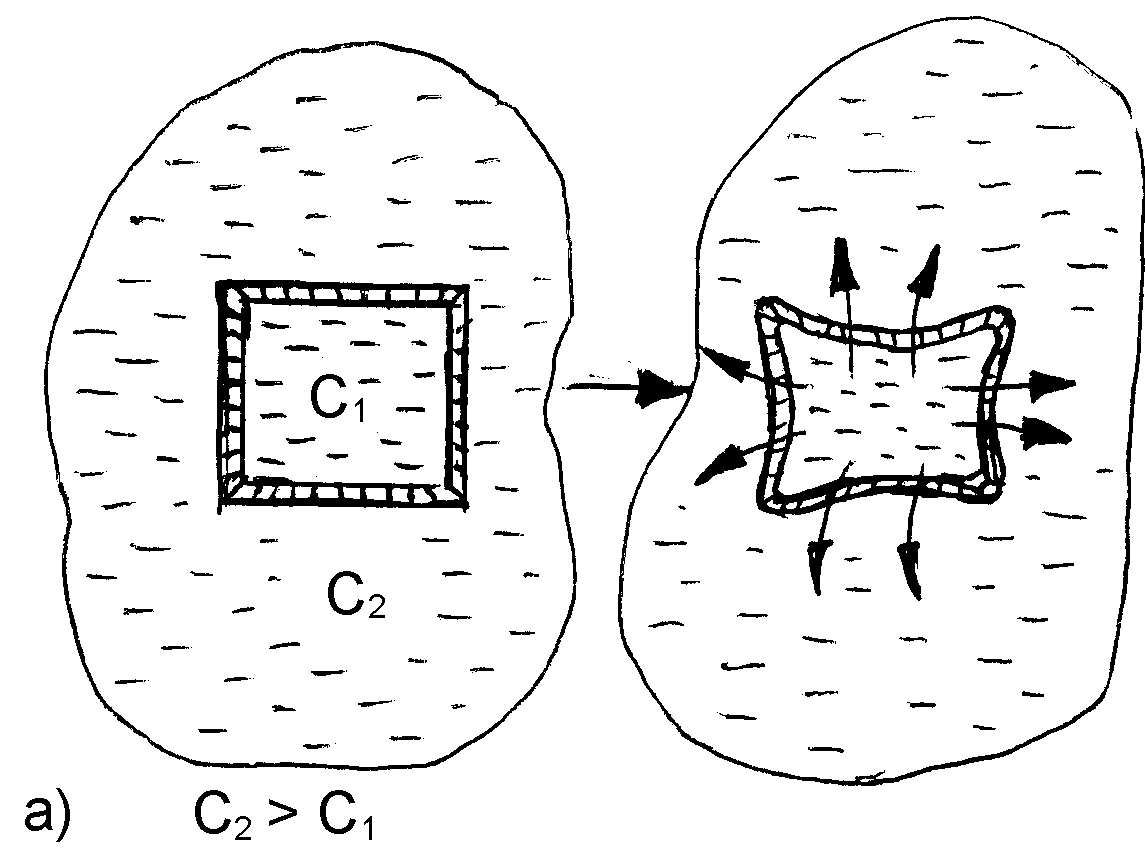

Рис. 25. Схематическое изображение процессов плазмолиза (а) и лизиса (б), протекающих в результате помещения клетки, соответственно, в гипертонический или гипотонический растворы.
Данное явление называется плазмолизомилиэкзосмосом.
Плазмолиз в большинстве случаев является обратимым процессом. Плазмолизированные клетки, помещенные в изотонический раствор, вновь набухают, восстанавливая свою жизнедеятельность. Но при слишком сильном и продолжительном обезвоживании клетка может потерять свою жизнеспособность.
При контакте с гипотоническим раствором вода из внешней среды переходит внутрь клетки. В результате этого увеличивается, и может произойти разрыв ее оболочки. Данное явление называется лизисом или эндосмосом (рис. 25).
Если в качестве клеточной культуры использовать эритроциты, то вследствие разрыва их оболочек внешняя среда окрасится гемоглобином в красный цвет. В этом случае данное явление называют иначе гемолизом(илиэритроцитолизом).
Гемолиз является частным случаем более общего явления – цитолиза (разрушения животных и растительных клеток под влиянием различных причин).
В крови разрушение оболочки у всех эритроцитов наступает если ее осмотическое давление снижается до 260-300 кПа. Цвет крови при этом частично изменяется и принимает характерный, «лаковый» оттенок.
В клинической практике в некоторых случаях могут применяться не только изотонические, но и гипертонические растворы. Например, в хирургии используют марлевые полоски, смоченные в гипертоническом растворе NaClдля наложения на гнойные раны. При этом вследствие осмоса ток жидкости направляется по марле наружу из раны, что способствует постоянному очищению раны от гноя, микроорганизмов, продуктов распада и т.д. (рис. 26).

Рис. 26. Принцип применения гипертонических повязок для очистки пораженных тканей от гноя и продуктов распада
Гипертонические растворы вводят внутривенно при глаукоме, чтобы снизить внутриглазное давление из-за повышенного содержания жидкости в передней камере глаза.
Явлением осмоса объясняют слабительное действие глауберовой (Na2SO4· 10H2O) и горькой (MgSO4· 7H2O) солей.
Эти соли плохо всасываются в кровь и поэтому их высокая концентрация в кишечнике вызывает интенсивный переход воды внутрь него из окружающих тканей, способствуя послабляющему действию.
Многие бактериальные клетки имеют высокое осмотическое давление. При действии антибиотиков (например, пенициллина) ингибируется процесс биосинтеза стенок растущих стрептококков. Они становятся непрочными и под действием внутреннего осмотического давления легко разрушаются.
Таким образом, понимание и контроль осмотических процессов, а также умение оказывать на их протекание то или иное воздействие имеет крайне важное значение в биологии и медицине.
Виды осмоса
Осмос, направленный внутрь ограниченного объёма жидкости (в клетку), называется (1) эндосмосом, наружу — (2) экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, т. е. создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя – (3) обратный осмос. В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, их перенос из раствора в воду позволяет осуществить (4) диализ, применяемый как способ очистки растворов биополимеров от низкомолекулярных примесей.
С точки зрения термодинамики движущей силой осмоса является стремление системы к выравниванию концентраций. Энтропия системы при растворении возрастает: ∆S0, энергия Гиббса системы уменьшается: ∆G<0.
Осмотическое давление – давление столба жидкости, которое нужно приложить к раствору, чтобы прекратить явление осмоса.
Осмотическое давление можно измерить.
Росм.= iCмRT
i = 1 + α(n-1),
где n – число ионов, на которые диссоциирует молекула электролита в воде,
α — степень диссоциации,
Cм — молярная концентрация,
R – универсальная газовая постоянная,
T – температура по Кельвину
Для сильных электролитов α = 1, для NaCl i = 2, для MgCl2i = 3
Осмотическое давление крови 740 — 780 кПа или ~7,3 — 7,7 атм.
1 атм = 101,3 кПа.
Осмолярность
Осмотическое давление создается веществами, которые не проходят через полупроницаемую мембрану, в результате препятствуют осмосу. Такие вещества называются осмотически активными. В организме это белки, глюкоза, ионы, в т.ч. Na+, K+, Cl—, HCO3—
Суммарная концентрация всех осмотически активных частиц называется осмолярностью (σ).
σ = Σ iCм [моль/л] или [осмоль]
Вещества, свободно проходящие через клеточные мембраны, называют осмотически неактивными. В крови человека к ним относят воду, все растворенные газы и мочевину.
Осмолярность крови рассчитывают по формуле:
σкрови = 2[Na+] + 2[К+] + [глюкоза] + 0,03[белок] = 0,3 моль/л
или 300 ммоль/л (0,3 осмоль или 300 мосмоль).
Почему при значительном снижении концентрации белков в плазме крови развивается отек окружающих тканей?
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку, проницаема лишь для молекул воды, кислорода, CO2, некоторых растворенных в крови питательных веществ и некоторых продуктов метаболизма. Для больших белковых молекул, находящихся в растворенном состоянии внутри клетки, мембрана непроницаема. Поэтому белки остаются внутри клетки и выполняют свои биологические функции.
Клетки человеческого организма живут 1.5-7 лет, самая короткая жизнь у клеток эпидермиса. Самая длинная – у клеток нервной системы и сердечных мышц (100 лет и более). И на всем протяжении жизни клеток мембраны должны выполнять свои функции.
Онкотическое давление
Белки удерживают на себе значительное количество воды (до 4 г воды на 1 г белка) в виде гидратной оболочки. В крови содержание белка колеблется от 60 до 80 г/л, если оно станет меньше 60 г/л, часть воды из плазмы крови выходит из сосудов в ткани. Возникает отек. Белки создают 0,75% осмолярности крови (расчет по формуле!). Осмотическое давление белков невелико, но оно очень важно для удержания воды в сосудистом русле.
Осмотическое давление, создаваемое белками, называется онкотическим (от латинского oncos – опухоль).
Влияние осмотического давления на клетки крови — эритроциты

Как видно из рисунка, только в изотоническом растворе клетки крови остаются неизмененными.
В обезвоженных тканях прекращается нормальный метаболизм и они отмирают в течение короткого времени. Особенно опасно это явление для клеток мозга: при незначительном обезвоживании за счет раздражения специальных осморецепторов (в гипоталамусе) развивается чувство жажды, при невозможности восполнения потерянной жидкости резко замедляется передача нервных импульсов, начинается гибель нейронов, человек теряет сознание, развивается кома. Ко́ма (коматозное состояние) (от греч. κῶμα — глубокий сон) — остро развивающееся тяжёлое патологическое состояние, характеризующееся прогрессирующим угнетением функций ЦНС с утратой сознания, нарушением реакции на внешние раздражители, нарастающими расстройствами дыхания, кровообращения и др.
Животные клетки имеют систему защиты, основанную на осморегуляции; организм животного стремится поддерживать осмотическое давление всех тканевых жидкостей на постоянном уровне.
Как работает система очистки воды обратного осмоса
Существует масса способов и систем очистки воды, но, ни один из них не может справиться с очисткой жидкости в том случае, если в ней присутствует большое количество минеральных веществ. Это становится просто невозможным, а к тому же и невыгодным с экономической точки зрения. В таком случае на помощь пройдет система очистки воды обратного осмоса.
Что собой представляет обратный осмос
Действие этого механизма, а точнее принцип, по которому он действует, позаимствован у природы. Все живые организмы питаются полезными веществами по точно такому же принципу.
Все материалы, которые существуют в нашей природе, можно условно разделить в зависимости от водонепроницаемости на три типа. Первый – материалы, пропускающие жидкость. Второй тип – непропускающие жидкость материалы. И третий вид – это пропускающие воду материалы, но задерживающие все загрязнений, которые растворены в ней. Их название – полунепропускные мембраны. Осмос – это процесс прохождения сквозь такие мембраны жидкости.
Пример обратного осмоса
Чтобы понять, что же это такое, рассмотрим небольшой пример. Нужно взять емкость и разделить ее на две равных части. Для разделении используем полунепропускную мембрану. В левую часть посудины нужно залить соляной раствор высокой концентрации, а в правую – такой же раствор, но с намного меньшим количеством соли. И один и второй раствор пытается сделать концентрацию соли равной. Именно поэтому из той части, где находится большая концентрация соли, жидкость перетекает туда, где соли меньше.
Именно так происходит выравнивание солености обеих жидкостей. Раствор в одной части понижается, а в другой, понятное дело повышается. Разница в этих уровнях ровно такая же, с какой силой было воздействие на процесс прохождения воды сквозь мембрану. Эту силу называют осмотическое давление, сам же происходящий процесс – обратный осмос.
Этот процесс может проходить точно так же, но с направлением в обратную сторону. Для этого необходимо оказывать давление на ту часть емкости, в которой уровень солесодержания более высокий. В результате в ней уменьшиться количество соляного раствора, но соли будут в большем количестве. Эта модель имеет названия обратного осмоса.
Обратноосмотические системы
Очищать воду на основе этой системы намного выгоднее, чем дистиллировать ее, причем как с конструкционной стороны, так и с экономической. Система очистки воды обратного осмоса дает возможность получить качественную и чистую воду, она работает намного эффективнее, нежели другие методы фильтрации.
Для изготовления обратноосмотических мембран используют синтетические полимерные материалы. Эта мембрана задерживает все высокомулярные типы загрязнений, а вот низкомолекулярные, наоборот, пропускает. К пропускаемым веществам относится углекислый газ, кислород, хлор.
Обратноосмотические системы разделяют воду на две части. Первая часть имеет название пермиат (это вода практически в идеально чистом состоянии), а вторая часть называется концентрат (все отделенные загрязнения). Концентратами являются вещества органического характера, коллоиды, микроорганизмы, растворенные соли.
Оболочка может иметь разные параметры, и в зависимости от этого, а также от условий очистки и от состава загрязнений, обратноосмотическая система может очистить воду от 94 до 99, 9%. Чтобы фильтровать жидкость, достаточное давление – от 7-25 атмосфер. Чтобы опреснить жидкость нужно до 70 атмосфер.
Преимущества обратноосмотических систем
- Мембрана имеет длительный срок службы – более трех лет.
- Рабочее давление относительно невысокое – от 8 до 10 атмосфер.
- Очистка воды до 99,7%.
- В канализацию сбрасывается лишь 25%.
- Наличие автоматизированной гидравлической промывки.
- Министерство здравоохранения разрешает использовать систему обратного осмоса в фармацевтической промышленности.
Если вы решили установить эту прекрасную систему, то вы должны знать, что изначально нужно разобраться с составом воды, которая поступает. Имеют смысл разные анализы, которые установят, какую нужно проводить предочистку воды.
Что купить проточный фильтр для воды или обратный осмос: Видео
Определение осмос общее значение и понятие. Что это такое осмос
На греческом языке мы можем найти этимологическое происхождение термина осмос. В частности, можно установить, что оно происходит от слова осмос, образованного двумя хорошо дифференцированными частями: осмос, что означает импульс, и суффикс -сис, который можно перевести как действие.
Осмос или осмос представляет собой физико-химический процесс, который относится к прохождению растворителя, но не растворенного вещества, между двумя растворами, которые разделены мембраной с характеристиками полупроницаемости. Эти растворы, с другой стороны, имеют разные концентрации.
Полупроницаемая мембрана — это мембрана, которая содержит поры молекулярного размера . Поскольку размер этих пор очень мал, через мембрану могут проходить только самые маленькие молекулы, а не более крупные.
Это означает, что, если одна из этих мембран отвечает за разделение жидкости и ее разделение на две части, могут возникать различные явления, объясняемые понятиями электрохимического потенциала и простой диффузии .
Первая концепция связана с тем, что при добавлении потенциала компонентов раствора результат будет превосходить химические компоненты каждого из них. Из-за этого отсутствия равновесия частицы растворителя будут перетекать в область с самым низким потенциалом, который известен как измеримое осмотическое давление . С другой стороны, растворитель будет направляться в растворенное вещество для достижения баланса потенциала или для достижения того, чтобы гидростатическое давление могло уравновесить осмотическое давление.
Точнее, мы можем определить, что существует два четко дифференцированных класса осмоса. Итак, прежде всего, мы находим так называемое явление прямого осмоса, которое представляет собой тот процесс естественного типа, который происходит во всех живых клетках и приводит к извлечению чистой воды из окружающей среды.
И тогда, во-вторых, мы находим обратный осмос. Это не явление, являющееся плодом Матери Природы, а процесс, изобретенный самим человеком, который состоит в «переворачивании» предыдущего типа осмоса. Следовательно, преследуемая цель состоит в том, чтобы получить очищенную воду, принимая в качестве отправной точки область соли или нечистой воды.
Способ достижения этой цели заключается в повышении давления, что способствует прохождению воды через полупроницаемую мембрану. И все это в направлении, противоположном тому, что происходит естественным путем.
Среди примеров, которые мы можем установить, чтобы понять процесс обратного осмоса, есть и такие простые, как пример, используемый для концентрирования сыворотки сыра или удаления алкоголя из пива, а также воды для орошения.
Важно подчеркнуть, что осмос — это явление, имеющее большое значение в физиологии клеток человека и животных.
Концепция осмоса, с другой стороны, используется для обозначения взаимного влияния, которое регистрируется у людей, входящих в одну и ту же группу.
Осмос — это… Что такое Осмос?
О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
Более широкое толкование явления осмоса основано на применении Принципа Ле Шателье — Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
 Жан-Антуан Нолле
Жан-Антуан НоллеИстория
Впервые осмос наблюдал А. Нолле в 1748, однако исследование этого явления было начато спустя столетие.
Суть процесса
 Рис. 1. Осмос через полупроницаемую мембрану. Частицы растворителя (синие) способны пересекать мембрану, частицы растворённого вещества (красные) — нет.
Рис. 1. Осмос через полупроницаемую мембрану. Частицы растворителя (синие) способны пересекать мембрану, частицы растворённого вещества (красные) — нет.Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими. Если принять меры, чтобы концентрации не менялись, осмотическое давление достигнет постоянной величины, когда обратный поток молекул воды сравняется с прямым.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выравнять концентрацию раствора в обоих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов.
Значение осмоса
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию.
Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом обратного осмоса жидкостей.
Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное давление). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
Использование в промышленности
Первая в мире электростанция — прототип, использующая для выработки электричества явление осмоса, запущена компанией Statkraft 24 ноября 2009 года в Норвегии вблизи города Тофте. Солёная морская и пресная вода на электростанции разделены мембраной; так как концентрация солей в морской воде выше, между солёной водой моря и пресной водой фьорда развивается явление осмоса, — постоянный поток молекул воды через мембрану в сторону солёной воды. В результате чего давление солёной воды возрастает.[1] Это давление соответствует давлению столба воды в 120 метров высотой, то есть достаточно высокому водопаду. Поток воды достаточен, чтобы приводить в действие гидротурбину, вырабатывающую энергию.[2] Производство носит ограниченный характер, основная цель — тестирование оборудования. Самый проблематичный компонент электростанции — мембраны. По оценкам специалистов Statkraft мировое производство может составить от 1 600 до 1 700 TWh, что сравнимо с потреблением Китая в 2002. Ограничение связано с принципом действия — подобные электростанции могут быть построены только на морском побережье.[3] Это не вечный двигатель, источником энергии является энергия солнца. Солнечное тепло отделяет воду от моря при испарении и посредством ветра переносит на сушу. Потенциальная энергия используется на гидроэлектростанциях, а химическая энергия долго оставалась без внимания.
