Карбонат натрия — Википедия
| Карбонат натрия | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий | ||
| Хим. формула | Na2CO3 | ||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| Рег. номер CAS | 497-19-8 | ||
| PubChem | 10340 | ||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E500(i) | ||
| RTECS | VZ4050000 | ||
| ChEBI | 29377 | ||
| ChemSpider | 9916 | ||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС |  | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
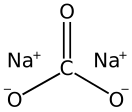
Карбона́т на́трия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na2CO3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода[1][2].
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na 2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- CO32−+h3O⇄HCO3−+OH−{\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3+h3SO4→Na2SO4+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии[3][неавторитетный источник?]. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана[править | править код]
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4+2C→Na2S+2CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- Na2S+CaCO3→Na2CO3+CaS{\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)[править | править код]
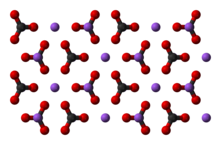 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- Nh4+CO2+h3O+NaCl→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3→otNa2CO3+h3O+CO2↑{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2Nh5Cl+Ca(OH)2→CaCl2+2Nh4+2h3O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2886 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу[править | править код]
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов[править | править код]
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[4].
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[5].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство[6].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.[источник не указан 93 дня]
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м3[1]. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии[7]. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
применение в быту, химическая формула, чем отличается от пищевой?
Кальцинированная сода является химически активным соединением, применяемым в разных областях человеческого быта. В домашних условиях используется для очищения поверхностей от устойчивых загрязнений и для стирки белья.
Человек научился употреблять с пользой для себя даже такие агрессивные вещества, как щелочи. Правильное применение кальцинированной соды может успешно заменить современные чистящие средства.
Что такое кальцинированная сода?
У кальцинированной соды есть несколько общепринятых названий: карбонат натрия, углекислый натрий, бельевая сода. Химическая формула этого вещества Na2CO3, натриевая соль угольной кислоты. Имеет кристаллическую структуру. Внешне определяется, как прозрачный или бесцветный порошок. Является субстанцией, быстро поглощающей влагу.
Согласно промышленным стандартам, относится к 3 классу опасности и требует соблюдения норм предосторожности при использовании. В быту применяется обычно в виде растворов или паст. При соединении с водой и нагревании щелочная реакция резко увеличивается.

Чем отличается от других видов?
Этот порошок является универсальным веществом, часто используемым в быту. Существует три разновидности данного химического соединения.
| Название | Водородный показатель | Область применения |
| Пищевая сода | Почти нейтральная реакция (pH — 8,1) | |
| Кальцинированная сода | Более щелочная реакция (pH — 11) | Промышленная сфера (стекольное производство, целлюлозно-бумажная индустрия, легкая и кожевенная промышленность, мыловарение, изготовление чистящих средств и т. д.). Бытовые цели. Не применяется для приготовления пищи |
| Каустическая сода | Самая едкая из данных щелочей (pH — 13) | Применение в быту требует соблюдения мер безопасности, промышленное производство |
Все представленные вещества являются щелочами, но непохожи друг на друга по своей силе и свойствам. Кальцинированная сода отличается от пищевой не только областью применения и щелочной реакцией. Внешняя разница между этими субстанциями заключается в плотности порошка: кальцинированная сода более рыхлая, образует нерастворимые хлопья в холодной воде.
Применение
Кальцинированная сода применяется во многих сферах. Она нужна для поддержания чистоты в доме, для сельскохозяйственных нужд, для санитарной обработки в учреждениях здравоохранения и общепита. С помощью этого недорогого и эффективного вещества можно:
- очистить кухонные поверхности от застарелого жира;
- избавиться от накипи в чайнике;
- приготовить средство для стирки белья;
- прочистить засор в канализационных трубах;
- нейтрализовать жесткость воды;
- избавиться от затхлого запаха в стиральной машине;
- удалить старую краску;
- дезинфицировать поверхности;
- бороться с вредителями растений и сорняками.
Карбонат натрия настолько универсален в своем употреблении, что использование его в домашних условиях получило широкое распространение у обывателей.
The YouTube ID of bsl4—mnQsw is invalid.Неправильное применение, несоблюдение дозировки при изготовлении раствора или нарушение процесса могут привести к различным негативным последствиям.
Химически активные соединения, к которым относится и углекислый натрий, требуют соблюдения мер безопасности. При хранении в домашних условиях кальцинированную соду следует держать подальше от детей и животных. Из-за высокого уровня поглощаемости влаги ее необходимо хранить в герметичной упаковке. Водный раствор карбоната натрия имеет более выраженную щелочную реакцию. Применять порошок и приготовленный состав следует в резиновых перчатках.
Большинство моющих средств, производимых химической промышленностью, имеет в своем составе карбонат натрия. Видоизмененный раствор с различными добавками является одним из основных компонентов современных гелей для стирки белья. Доступным и эффективным аналогом промышленных чистящих средств может стать кальцинированная сода. Универсальный порошок уже долгое время помогает справляться человеку с различными бытовыми потребностями.
Кальцинированная сода в быту: советы, применение, рецепты.
Сода всегда находит применение, она есть на кухне почти у всех. Но под словом сода зачастую понимается пищевая, однако, кроме нее существует также кальцинированная сода, имеющая множество применений в хозяйстве.
Свойства кальцинированной соды
Кальцинированная сода — химическое соединение карбоната натрия с формулой Na2CO3. В природе существует во многих водорослях, а также в нескольких минералах, из которых ее и получают. Плавится при температуре более 850 градусов по Цельсию и не является пожароопасным веществом.
Кальцинированная сода отлично растворяется в воде, ее необходимо хранить в сухих помещениях с влажностью воздуха менее 75%. Не стоит хранить соду в ванной.
Читайте также: Кальцинированная сода: формула. производство, свойства и применение.

Отличие кальцинированной соды от пищевой
Кальцинированная сода, в отличие от пищевой, является сильнейшей щелочью, и в связи с этим применяется в основном на производстве и в качестве замены некоторым средствам бытовой химии.
Пищевая сода применяется в готовке, в качестве средства дезинфекции зубов и полости рта, как средство от изжоги и при тушении пожаров. Кальцинированную же, как более опасную, применяют в производстве: мыловарении, выдувке стекол, в качестве компонента многих чистящих средств и некоторых эмалей, для размягчения воды и обезжиривания металлов.
Читайте также: Чистка зубов содой.
Никогда не используйте карбонат натрия в приготовлении пищи. Данное вещество, попадая в организм, может вызвать отравление.
Меры предосторожности
Кальцинированная сода токсична, и вызывает сильное отравление при попадании в организм. При использовании необходимо выполнять несколько простых правил:
- перед применением обязательно надевать резиновые перчатки;
- хранить в сухом помещении, отдельно от пищи и медикаментов;
- хранить в недоступном для детей месте;
- в случае попадания в глаза или рот требуется немедленно промыть их большим количеством воды;
- обязательно соблюдать требуемые пропорции.
Применение кальцинированной соды в быту
Карбонат натрия широко применяется в быту, и используется для:
- уничтожения засоров;
- удаления въевшейся грязи, жира;
- снятия старых слоев краски;
- чистки керамических, эмалевых и кафельных поверхностей;
- чистки фарфоровой посуды;
- дезинфекции;
- стирки.
Стирка
Кальцинированную соду часто еще называют бельевой содой, и не зря, она отлично подходит для ручной и машинной стирки, замачивания и кипячения белья. Она помогает в стирке вещей из:
Нельзя использовать соду для стирки вещей из:
- шерсти;
- шелка;
- кожи;
- замши;
- синтетики;
- кружевных вещей;
- вещей со специальным покрытием;
- вещей с мембранной поверхностью.
Замачивание белья
Для замачивания белых вещей, перед стиркой необходимо положить белье на 8-10 часов в таз с растворенной содой в пропорции 3 столовые ложки на 5 литров воды. Перед началом замачивания натрите одежду хозяйственным мылом, либо добавьте его в воду. После замачивания белье по-прежнему будет иметь серый оттенок, однако, после стирки белье вновь станет белоснежным.
Не замачивайте белье снова, если после 8-10 часов замачивания, оно по-прежнему имеет серый цвет, вещи станут белее сразу после стирки.
Для замачивания цветных вещей также используется сода, но ее пропорции должны быть другими: 3-4 ст. л. на 10 л теплой воды. Не кипятите цветные вещи с кальцинированной содой.

Ручная стирка
При ручной стирке, необходимо придерживаться простых правил безопасности:
- не допускать попадания раствора на слизистую оболочку глаз и рта;
- одевать резиновые перчатки перед стиркой;
- не допускать детей к раствору кальцинированной соды;
- после стирки смазать руки кремом.
Соблюдая данные нехитрые правила вы без проблем сможете стирать, не используя дорогие порошки или отбеливатели. Ручная стирка проводится в растворе 3 столовые ложки на 5 литров воды.
Машинная стирка
Для машинной стирки карбонат натрия используют в качестве средства для удаления накипи и известкового налета, в качестве смягчителя воды, а также как компонент стиральных гелей и порошков.
Если вы используете недорогой стиральный порошок, то добавьте к нему 3 столовые ложки карбоната натрия. Это поможет вам лучше отстирать вещи, и сохранит их дольше. Температурный режим рекомендуется выставлять в пределах 50-100 градусов, для более активного выведения пятен.
Кипячение белья
При кипячении белья карбонат натрия используется в качестве отбеливающего средства. Необходимо взять эмалированную или стальную емкость, налить в нее 10 л. воды, засыпать 500 гр. соды и 500 гр. «Белизны» или иного отбеливателя с хлором. Кипятите белье в течение 40-60 минут в проветриваемом помещении.
Не используйте посуду из меди и алюминия, белье может испортится и покрыться пятнами. Не используйте кипячение для цветных и деликатных тканей. Кипячение белья лучше всего проводить в проветриваемом помещении.
Стиральный гель
Карбонат натрия является одним из основных ингредиентов геля для стирки. Его компоненты недороги, а полученное вещество является сильным и мягким средством, применяемым даже при стирке детской одежды.
Изготовление требует выполнения нескольких шагов:
- Наполнить двухлитровую кастрюлю холодной водой и поставить её кипятиться. При закипании необходимо отправить в воду порезанное или натертое хозяйственное мыло из расчета 100 гр. на литр.
- После полного растворения мыла необходимо добавить 150 грамм соды, затем оставить смесь кипеть в течение 3-4 минут.
- Для защиты кожи рук можно также добавить листовой зеленый чай из расчета 100 гр. на литр.
- Для аромата после остывания геля можно добавить к нему немного цветочного масла.
Для борьбы с накипью в стиральной машине достаточно просто стирать вещи с добавлением кальцинированной соды.
Чистка содой
Дезинфекция
С помощью кальцинированной соды можно проводить дезинфекцию помещений, для этого достаточно создать раствор из смеси мыла и карбоната натрия в расчете 10 гр. каждого вещества на один литр жидкости. Благодаря этому вы получите однопроцентный раствор чистящего средства. Данным средством можно проводить дезинфекцию любой поверхности, однако, если вы хотите проводить дезинфекцию кафеля, вам понадобится 2-3 процентный раствор.
Альтернативный способ — размешать полученный двухпроцентный раствор с еще одним из расчета 1 к 1. Для приготовления второго раствора, на литр воды берут 20 грамм соды и 5 грамм чистящего порошка.
Обязательно работайте в прорезиненных перчатках, используя смесь сразу после создания. Обрабатывать поверхности рекомендуется ежедневно, обязательно проветривая дезинфицируемое помещение.
Читайте также: Мыльно-содовый раствор.
Чистка пола
Для мытья пола надо развести 2-3 ст. л. соды на 5 л теплой воды. После чистки раствором, необходимо повторно промыть пол чистой водой.
При мытье керамических поверхностей необходимо в приготовленный раствор залить 2-3 ст. л. жидкого мыла.
Не рекомендуется чистить деревянные и кирпичные поверхности, ламинат, паркет. Карбонат натрия также разъедает эмали, краски, лак и натяжные потолки.
Читайте также: Чистка ковров содой.
Чистка сантехники
Для очистки сантехники от грязи необходимо растворить 2 ст. ложки в 1 литре теплой воды. Это позволит справиться с текущей грязью, но не сможет удалить въевшееся загрязнение.
Для очистки въевшихся загрязнений подойдет следующий рецепт:
- Объединяются две соды — кальцинированная и пищевая в пропорции 1:1.
- Смесь насыпается на место, требующее очистки, предварительно смоченное теплой водой.
- Оставить смесь на полчаса.
- Смочить губку уксусом
- Не смывая соды тщательно протереть поверхность, после чего оставить ее еще на полчаса.
- Через полчаса повторить процедуру и промыть поверхность теплой водой.
Читайте также: Чистка ванны содой.
Удаление засоров
Карбонат натрия — хорошее средство против засоров. Существует два рецепта ее использования при появлении засоров:
Рецепт 1
- в слив трубы засыпается полстакана карбоната натрия
- заливается 1 л кипятка
- оставить смесь на полчаса
- спустить воду не менее 1-2 минут для прочистки трубы.
Рецепт 2
- в слив трубы засыпается 5 столовых ложек кальцинированной соды и 5 столовых ложек обычной пищевой соды;
- через полчаса вливается половина стакана 9% уксуса;
- затем в слив заливается полстакана хлорного отбеливателя;
- слив закрывается пробкой, открываются все окна в помещении для проветривания и смесь оставляется на полчаса в трубах;
- через полчаса необходимо убедиться, что засор устранен и спустить воду не менее 5-10 минут.
При использовании данного способа выделяются едкие пары хлора. Обязательно используйте данный способ только в проветриваемом помещении. Обязательно выйдите из помещения и в течение минимум полу часа после прочистки засора проветривайте помещение.
Читайте также: Удаление засоров каустической содой
Применение кальцинированной соды на кухне
Карбонат натрия применяется на кухне при чистке загрязнений рабочих поверхностей и бытовой техники.
Чистка бытовой техники
СВЧ, тостеры, мультиварки, соковыжималки, кофеварки и прочую бытовую технику можно чистить кальцинированной содой. Для этого необходимо сделать раствор из расчета 3 ст. ложки на 1 литр теплой воды, помыть выбранные поверхности раствором, и после промыть все поверхности водой и насухо протереть.
Газовые и электрические плиты, духовые шкафы
Для чистки плит, печей и духовых шкафов необходимо добавить в раствор немного силикатного клея.
- в раствор, приготовленный ранее (3 ст. л. соды на 1 л воды), следует добавить 1 ст. л. силикатного клея;
- добавить 1 стакан теплой воды, в котором растворена 1/2 ст. л. стирального порошка;
- полученный раствор растереть по всем очищаемой поверхности;
- удалить размягченную грязь влажной губкой;
- при необходимости повторить процедуру.
Раствор следует хранить в плотно закупоренной емкости. Перед повторным применением рекомендуется его тщательно перемешать.
Очистка чайника от накипи
Для удаления накипи с чайника существует два способа. В первом чайник ставят на плиту, с раствором карбоната натрия в пропорции 1 ч. л. на 1 л воды, и доводят до кипения. Во втором вручную оттирают накипь содой.
При чистке чайника вручную обязательно используйте перчатки.
Чистка кастрюлей и сковород от нагара
Карбонат натрия хорошо растворяет въевшееся загрязнение с эмалированных и керамических сковород и кастрюль. Для очистки посуды необходимо приготовить следующие ингредиенты:
- большую стальную емкость;
- 1 уп. карбоната натрия;
- 2-3 пузырька силикатного клея;
- 200 гр. хозяйственного мыла;.
Рецепт:
- в большую емкость поместить все кастрюли и сковороды;
- полностью залить посуду водой;
- поставить емкость на плиту и засыпать в нее 1 уп. соды и силикатный клей;
- добавить 200 гр. тертого хозяйственного мыла;
- прокипятить 20-180 минут, в зависимости от степени загрязнения;
- тщательно промыть посуду губкой под струей воды.
Не рекомендуется чистить таким образом алюминиевую и чугунную посуду, так как сильная щелочь разрушает эти металлы.
Посуда
Для очищения кухонной утвари от загрязнения и отбеливания пожелтевшей эмали тоже применяется кальцинированная сода. В кипяченой воде смешивают соду, в соотношении 3 ст. ложки на 1 л воды.
Соду используется и в посудомоечной машине, для этого необходимо на одну загрузку использовать 2 ч. л. буры (бурата натрия) и 2 ч. л. соды. При половинной загрузке посудомоечной машины можно использовать по 1 ч. л. каждого вещества.
Читать подробнее в статье: Кальцинированная сода на кухне.
Применение кальцинированной соды в саду
Карбонат натрия используется во многих местах, так что он находит свое применение и в саду. Он способствует защите от мучнистой росы и некоторых менее распространенных болезней, распространяющихся из-за влажного климата.
Мучнистая роса
Для противостояния мучнистой росе надо сделать раствор по следующему рецепту:
- Налить 10 л воды;
- Взять 2 ст. л. карбоната натрия и 40 грамм тертого хозяйственного мыла;
- Тщательно размешать до полного растворения;
Зараженные растения необходимо опрыскивать 1-4 раза в неделю исходя из силы поражения растений. Рекомендуется использовать раствор в безветренную погоду, при отсутствии осадков и невысокой температуре.
Для профилактики мучнистой росы необходимо дважды обработать растения через равные промежутки времени между завязью почек и отцветанием растения.
Обработка многолетних цветов
Для обработки многолетних цветов растворяют четыре столовые ложки соды в 5 литрах воды. Цветы обрабатывают один — два раза в неделю на протяжении вегетации — момента с начала роста растения, до окончания процесса размножения.
Гниющие растения можно попробовать спасти, используя карбонат натрия. Необходимо размешать 1 ст. л. соды в 10 л воды. Смесь заливают в лейку, после чего поливают растения. Рекомендуется поливать не чаще двух раз в месяц.
Калиновый листоед
Для защиты от калинового листоеда необходимо
- взять 200 грамм калийного мыла;
- смешать с 1 ст. л. кальцинированной соды;
- растворить смесь в ведре воды;
Полученным раствором необходимо опрыскивать внутреннюю сторону листьев не более 1 раза в 7 дней до исчезновения насекомых.
Обработка роз
Для профилактической обработки роз необходимо:
- 5 л воды;
- 1 ч. л. карбоната натрия;
- 1 ч. л. соли Эпсома;
- ½ ч. л. нашатыря;
Данной смесью необходимо поливать, и опрыскивать внешнюю сторону цветков не чаще трёх раз в месяц через равные промежутки времени. Молодые розы лучше опрыскивать без нашатыря, поскольку он плохо сказывается на развитии растений на ранней стадии.
В ландшафтном дизайне
При создании ландшафтного дизайна карбонат натрия используется в качестве средства против сорной травы. При прокладке плитки достаточно засыпать соду в швы между плитками или обработать швы однопроцентным раствором. После процедуры следует накрыть плитки для защиты от осадков на две недели, затем помыть их вручную или дождаться дождя.
В данном видео автор рассказывает о применении кальцинированной соды в саду как средство защиты кустарников от тли и нескольких болезней, включая серую гниль и мучнистую росу.
Читайте подробнее: Кальцинированная сода на огороде.
Что нельзя чистить кальцинированной содой
Не рекомендуется мыть алюминиевую и чугунную посуду, поскольку щелочь разъедает алюминий, а с чугуна съедает защитное покрытие.
Также нельзя чистить деревянные и кирпичные поверхности, ламинат, паркет. Карбонат натрия разъедает эмали, краски, лаки. Нельзя мыть ей натяжные потолки.
Запрещается проводить стирку шерстяных, шелковых, замшевых и кожаных вещей, вещей с мембранными и специальными покрытиями, а также кружевные и синтетические вещи.
Хранение кальцинированной соды
Соду необходимо хранить в сухом помещении, в закрытой емкости и не допускать детей к данному веществу.
Срок хранения кальцинированной соды составляет не более 25 суток с момента открытия.
Где купить кальцинированную соду
Карбонат натрия продается в большинстве магазинов, занимающихся продажей бытовой химии.
Кальцинированная сода является отличным средством для чистки различных бытовых предметов, защиты садовых растений и дезинфекции помещений. В отличие от пищевой соды она применяется только в хозяйственных целях, и ее применение в приготовлении пищи строго запрещено.
ЩЕЛОЧЕЙ ПРОИЗВОДСТВО | Энциклопедия Кругосвет
Содержание статьиЩЕЛОЧЕЙ ПРОИЗВОДСТВО, содовая промышленность, производство кальцинированной соды (карбоната натрия Na 2CO3) и ряда аналогичных продуктов. В широком смысле слово «щелочь» относится к большому числу химических соединений, хорошо растворимых в воде и создающих в водном растворе высокую концентрацию гидроксид-ионов, например аммиаку, гидроксиду аммония и гашеной извести (гидроксиду кальция), которые были побочными продуктами устаревшего технологического процесса производства синтетической кальцинированной соды. Щелочи – растворимые активные вещества из более широкого класса оснований.
Кальцинированная сода.
Технический карбонат натрия Na2CO3 (кальцинированную соду) применяют главным образом в производстве стекла и химикатов. Около половины кальцинированной соды идет на изготовление стекла, около четверти – химикатов, 13% – мыла и моющих средств, 11% употребляется на такие цели, как изготовление целлюлозы и бумаги, рафинирование металлов и нефти, дубление кожи и очистка воды, а остальное поступает в продажу.
Природные месторождения.
Кальцинированная сода встречается в природе в больших количествах, главным образом в соляных пластах и отложениях троны (минерала состава Na2CO3ЧNaHCO3Ч2H2O). На Земле известны более 60 таких месторождений.
Процесс Сольве.
Осуществленный в конце 1860-х годов двумя бельгийцами, братьями Эрнестом и Альфредом Сольве, аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия. На практике процесс проводят, вводя в почти насыщенный раствор хлорида натрия сначала аммиак, а потом диоксид углерода. Гидрокарбонат натрия выпадает в осадок, когда диоксид углерода вводится в раствор:
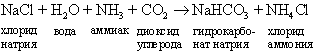
Прокаливая отфильтрованный гидрокарбонат натрия, получают карбонат натрия и диоксид углерода, который используют повторно:
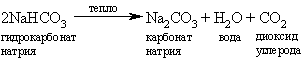
Экономичность процесса Сольве связана с тем, что аммиак регенерируется путем обработки раствора хлорида аммония оксидом кальция, который получают из карбоната кальция путем нагрева (при этом одновременно образуется также используемый в процессе диоксид углерода):
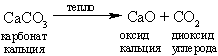

Хлорид кальция, образующийся в процессе извлечения аммиака, является важным побочным продуктом.
Электролизный процесс.
Карбонат натрия можно также получить посредством электролизного процесса. Водяной пар и диоксид углерода запускаются в катодное отделение установки с камерой диафрагменного типа для электролиза растворов солей, где, взаимодействуя с едким натром, они превращают его в карбонат натрия.
Щелок.
Наименование «щелок» (K2CO3, Na2CO3, NaOH) было присвоено продуктам, получаемым путем выщелачивания древесной золы. Она содержит приблизительно 70% карбоната калия (поташа), используемого в основном для изготовления мыла и стекла. Карбонат натрия (кальцинированная сода) – главный компонент золы некоторых растений (солянок). Путем обработки гашеной известью (гидроксидом кальция) карбонат натрия превращают в каустическую соду (гидроксид натрия), которая применяется для бытовых и промышленных целей под названием «щелок» или «каустик».
Поташ.
Хотя в химической промышленности поташем называют главным образом карбонат калия (K2CO3), в сельском хозяйстве это наименование охватывает все соли калия, идущие на изготовление удобрений, но в основном хлорид калия (KCl) с небольшой примесью сульфата калия (K2SO4).
Обычные способы получения поташа – электролизный процесс с участием гидроксида калия и более распространенный процесс на основе химического взаимодействия смеси хлорида калия и карбоната магния с диоксидом углерода. В результате этой реакции образуется нерастворимая двойная соль гидрокарбоната калия и карбоната магния, которая при нагревании разлагается на карбонаты калия и магния, воду и диоксид углерода.
Карбонат калия применяется в производстве стекла, солей калия, красителей и чернил. Карбонат калия – важный компонент специальных стекол, например оптических и лабораторных.
Каустическая сода (едкий натр). Гидроксид натрия NaOH получил свое название по причине сильного разъедающего действия на животные и растительные ткани.
Каустическую соду получают либо путем электролиза раствора хлорида натрия (NaCl) с образованием гидроксида натрия и хлора, либо, реже, с помощью более старого способа, основанного на взаимодействии раствора кальцинированной соды с гашеной известью. Большое количество производимой в мире кальцинированной соды используется для получения каустической соды.
Взаимодействие раствора кальцинированной соды с гашеной известью.
Каустическую соду получают из кальцинированной на установке периодического или непрерывного действия. Процесс обычно проводят при умеренных температурах в реакторах, оборудованных мешалками. Реакция образования каустической соды представляет собой реакцию обмена между карбонатом натрия и гидроксидом кальция:
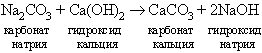
Карбонат кальция выпадает в осадок, а раствор гидроксида натрия отводится в коллектор.
Электролизные методы.
Когда концентрированный раствор хлорида натрия подвергается электролизу, образуются хлор и гидроксид натрия, но они реагируют друг с другом с образованием гипохлорита натрия – отбеливающего вещества. Этот продукт, в свою очередь, особенно в кислых растворах при повышенных температурах, окисляется в электролизной камере до перхлората натрия. Чтобы избежать этих нежелательных реакций, электролизный хлор должен быть пространственно отделен от гидроксида натрия.
В большинстве промышленных установок, используемых для получения электролизной каустической соды, это осуществляется с помощью диафрагмы, помещенной вблизи анода, на котором образуется хлор. Существуют установки двух типов: с погруженной или непогруженной диафрагмой. Камера установки с погруженной диафрагмой целиком заполняется электролитом. Соляной раствор втекает в анодное отделение, где из него выделяется хлор, а раствор каустической соды заполняет катодное отделение. В установке с непогруженной диафрагмой раствор каустической соды отводится из катодного отделения по мере образования, так что камера оказывается пустой. В некоторых установках с непогруженной диафрагмой в пустое катодное отделение напускается водяной пар, чтобы облегчить удаление каустической соды и поднять температуру.
В диафрагменных установках получается раствор, содержащий как каустическую соду, так и соль. Большая часть соли выкристаллизовывается, когда концентрация каустической соды в растворе доводится до стандартного значения 50%. Такой «стандартный» электролизный раствор содержит 1% хлорида натрия. Продукт электролиза пригоден для многих применений, например для производства мыла и чистящих препаратов. Однако для производства искусственного волокна и пленки требуется каустическая сода высокой степени очистки, содержащая менее 1% хлорида натрия (соли). «Стандартный» жидкий каустик можно надлежащим образом очистить методами кристаллизации и осаждения.
Непрерывное разделение хлора и каустика можно также осуществить в установке с ртутным катодом. Металлический натрий образует с ртутью амальгаму, которая отводится во вторую камеру, где натрий выделяется и реагирует с водой, образуя каустик и водород. Хотя концентрация и чистота соляного раствора для установки с ртутным катодом более важны, чем для установки с диафрагмой, в первой получается каустическая сода, пригодная для производства искусственного волокна. Ее концентрация в растворе составляет 50–70%. Более высокие затраты на установку с ртутным катодом оправдываются получаемой выгодой.
Применение.
Наиболее важные области потребления каустической соды (перечислены в порядке уменьшения потребляемого количества) – химическое производство; переработка нефти; производство искусственного волокна и пленки, целлюлозы и бумаги, алюминия, моющих средств и мыла; обработка тканей; рафинирование растительного масла; регенерация резины.
Каустический поташ (едкое кали). Соединения калия менее распространены и поэтому более дороги, чем соответствующие соединения натрия. Они применяются только в тех случаях, когда необходим присущий им комплекс физико-химических свойств, не обеспечиваемый соединениями натрия. Гидроксид калия KOH, в обиходе называемый каустическим поташем, не является исключением из этого правила. Подобно каустической соде, каустический поташ можно получить путем обработки раствора карбоната калия K2CO3 гашеной известью Ca(OH)2 или электролизом раствора хлорида калия. Этот материал продается в виде массивных блоков, хлопьевидной массы, гранул или небольших кусков, а также 40 и 50%-х растворов.
Применение.
Главная область применения гидроксида калия – производство мягкого мыла. Смеси калиевых и натриевых мыл используются для получения жидких мыл, моющих средств, шампуней, кремов для бритья, отбеливателей и некоторых фармацевтических препаратов. Другая важная область применения каустического поташа – производство различных солей калия. Например, перманганат калия получают путем сплавления диоксида марганца с каустическим поташем и последующего окисления образовавшегося манганата калия в электролизной камере. Дихромат калия можно получить аналогичным способом, хотя чаще его изготовляют сплавлением тонко измельченной хромитной руды (FeO Ч Cr2O3) с карбонатом или гидроксидом калия и воздействием на полученный хромат кислотой с образованием дихромата калия. Каустический поташ также применяют вместе с каустической содой в производстве многих красителей и других органических соединений. См. также МЫЛО; МОЮЩИЕ СРЕДСТВА; ЦЕЛЛЮЛОЗА; ЦЕЛЛЮЛОЗНО-БУМАЖНАЯ ПРОМЫШЛЕННОСТЬ.
свойства, применение в быту и огороде
Кальцинированная сода нашла свое применение не только в промышленном производстве, но и в быту. Этот белый порошок хорошо очищает и дезинфицирует, что делает его незаменимым недорогим помощником в доме.

Фото: Sodasovet.ru. Автор: Сигаева Ольга.
Особенности
Химическая формула кальцинированной соды — Na2CO3. Её называют также карбонатом натрия или натриевой солью угольной кислоты. Имеет белый цвет и выпускается в форме гранул или порошка.
Вещество не обладает характерным запахом и растворяется в воде. Кристаллы легко впитывают влагу и запахи. При этом углекислоты карбоната натрия могут выделять кислые соли.
Кальцинированную соду получают путем переработки минералов, а также в ходе аммиачно-содового процесса.
Свойства
Карбонат натрия легко вступает в химические реакции. Благодаря этой характеристике вещество активно применяют в промышленном производстве. Оно участвует в производстве красок, лаков и стекла.
Свойство кальцинированной соды смягчать воду и удалять сложные загрязнения сделало ее любимым чистящим средством многих хозяек.
Но не стоит пользоваться порошком, не зная правила применения.
Внимание! По воздействию на человека имеет третий класс опасности. Ошибки могут вызвать ожог или порчу вещей.
Отличие от каустической и питьевой соды
Все три вида соды отличаются друг от друга щелочной силой и свойствами, благодаря которым разнятся их сферы применения:
| Наименование | pH | Сфера применения |
|---|---|---|
| Пищевая сода | 8,1 | Пищевые и бытовые цели. |
| Кальцинированная сода | 11 | Промышленность и бытовые нужды. |
| 13 | Промышленность (в пищевой сфере как E524). Сильная щелочь! В бытовых условиях применяется, но со строгим соблюдением мер предосторожности. |
Меры предосторожности
- Перед работой с кальцинированной содой в быту надевают перчатки. Вещество нарушает водно-жировой баланс кожного покрова. Если превысить рекомендуемое количество, то можно спровоцировать ожог. Использовать вещество без защиты при открытых повреждениях на теле не рекомендуется, так как оно начинает щипать.
- Емкость со кристаллами хранят отдельно от пищевых продуктов. Дети и животные не должны иметь доступ к месту хранения.
- Натриевая соль в условиях повышенной влажности комкуется, поэтому ее хранят в сухом помещении.
- Порошок запрещено использовать для приготовления пищи.
- Чем выше температура раствора, тем активнее действуют кристаллы. При использовании средства в бытовых условиях необходимо учитывать этот факт, чтобы не повредить кожу или вещи.
Применение кальцинированной соды в быту
Кухня
Средство для мытья посуды
В момент, когда старое средство закончилось, а новое еще не куплено, поможет содовый раствор.
Его готовят из 3 ст. л. порошка и 1 л теплой воды. Жидкость эффективно растворяет жир. После этого посуду промывают под проточной водой.
Очистка от трудных загрязнений
Способ поможет для устранения желтизны со старых столовых приборов и удаления жира и накипи с керамической и эмалированной посуды.
- Берут металлическую ёмкость (подходящую по размеру к объёму имеющейся посуды), куда складывают все грязные предметы. Заполняют её водой и ставят на огонь.
- Через 5 минут в ёмкость помещают приблизительно полкилограмма кальцинированной соды (количество зависит от количества жидкости), 2 тюбика силикатного клея и при желании немного мыльной стружки.
- Если загрязнения не слишком сильные, то посуду кипятят около 30 минут. Если она слишком загрязнена, то время увеличивают до нескольких часов.
- Когда изделия остынут, их достают и моют под проточной водой с помощью тряпочки.
Для очистки кафеля
Состав можно использовать для мытья плитки в любом помещении.
На 1 л тёплой воды берут 60 г натриевой соли и мешают до полного исчезновения кристаллов. Полученным раствором моют поверхность специальной жёсткой губкой. После процедуры плитку обрабатывают влажной тканью.
Паста для чистки плиты
Потребуется 3 части натриевой соли, 1 часть силикатного клея и 1 часть порошка для стирки. Все составляющие перемешивают в стакане воды до однородного состояния. Приготовленный состав наносят на въевшиеся загрязнения. После этого место протирают влажной губкой.
Если средство еще осталось, то его помещают в банку и хранят герметично закрытой.
Чистка сантехники
Содово-мыльная смесь
- Хозяйственное мыло натирают на тёрке и смешивают с кальцинированной содой в одинаковых пропорциях.
- В смесь наливают немного воды, чтобы довести её до состояния кашицы.
- Для придания аромата можно капнуть немного эфирного масла.
- На поверхность загрязнённой сантехники наносят приготовленную смесь, а через час удаляют тряпочкой и споласкивают чистой водой.
Обработка уксусом и содой
Перед чисткой ванны кальцинированной содой её протирают уксусом, а потом на 10 минут засыпают содой. Загрязнения чистят щёткой и споласкивают водой.
Метод также применим к другой сантехнике.
Смесь из двух видов соды
- Кальцинированную и пищевую соду смешивают в соотношении один к одному.
- Состав разбавляют водой до состояния пасты. Ее наносят на необходимое место и ждут 15 минут.
- В это время готовят раствор из 50 мл уксуса и отбеливателя. Им по истечении времени протирают поверхность и оставляют для взаимодействия на полчаса.
- Чистящую смесь смывают влажной тряпочкой.
Чистка труб от засоров
Способ № 1 — с кипятком
Метод помогает в том случае, когда вода уходит, но медленно. В результате труба дезинфицируется, и из неё удаляются жировые отложения.
В слив засыпают 1 стакан карбоната натрия так, чтобы весь порошок оказался внутри. Сверху наливают 3 стакана кипятка.
Если желаемый эффект не достигнут, то манипуляцию повторяют второй раз спустя некоторое время.
Способ № 2 — с уксусом
Подготавливают соду и 9%-й уксус в равных пропорциях. Сначала в трубу засыпают щелочной порошок, а затем заливают кислотой. Нужно подождать некоторое время, пока реакция в отверстии прекратится. В завершение трубу промывают теплой водой.
Стирка
Замачивание
- В 10 л тёплой воды с температурой 40 °C насыпают не более 3 ст. л. карбоната натрия.
- В неё кладут загрязнённые вещи и оставляют на ночь.
- Предварительно изделия натирают хозяйственным мылом или антипятином.
- Утром белье помещают в стиральную машину и стирают в режиме, подходящем для данного типа ткани.
Этот способ не рекомендуется использовать для стирки цветного белья.
От сильных загрязнений
При стирке вещей со сложными пятнами, например, от жира или бензина, в отсек для порошка, помимо средства для стирки, добавляют до 5 л. щелочного средства.
Конкретное количество выбирают в зависимости от интенсивности загрязнения и жёсткости воды.
Удаление накипи и известкового налёта
Простой способ
Он подходит для всех типов поверхностей.
- Ёмкость заполняют водой на 2/3 объёма. В неё насыпают 3 ст. л. натриевой соли.
- Посуду ставят на огонь и кипятят 20 минут.
- По истечении времени ёмкость снимают с плиты и отставляют в сторону на час.
- Размягчённую поверхность чистят с помощью железной губки и споласкивают.
С лимонкой
- В ёмкость наливают воду и насыпают по 2 ч. л. карбоната натрия и лимонки на каждый литр жидкости.
- Посуду ставят на огонь и кипятят четверть часа.
- Через час манипуляцию повторяют заново.
- Раствор сливают и при необходимости счищают оставшиеся куски накипи.
- В ёмкость наливают обычную воду и кипятят, чтобы избавиться от остатков чистящего средства.
Мытьё полов
Для приготовления чистящего средства 60 г соды растворяют в 5 л тёплой воды. В него окунают мягкую половую тряпку и моют пол обычным способом. В завершение поверхность обрабатывают чистой водой.
Внимание! Щелочной порошок не используют для мытья ламината, лакированного паркета, а также окрашенного, невощенного или деревянного пола,
Дезинфекция
Если кто-либо из домочадцев подхватил вирусную инфекцию, то поможет предупреждающая мера.
- В ведре воды разводят по 200 г соды и тёртого хозяйственного мыла.
- Для мытья кафельной плитки мыло заменяют 50 граммами порошка для стирки.
- Средство используют сразу после приготовления раз в день для протирания поверхностей.
- После дезинфекции нужно проветрить помещение.
Использование в саду и огороде
От сферотеки на крыжовнике
- 3 ст. л. вещества и 1 ст. л. тёртого хозяйственного мыла разводят в 10 л воды.
- Раствором проводят опрыскивание пораженного растения после того, как оно перестанет цвести.
- Чтобы закрепить результат, через 7 дней сеанс насаждения снова обрабатывают.
От мучнистой росы на огурцах
В ведре воды растворяют 2 ч. л. кальцинированной соды. Приготовленным составом орошают гряду с пораженными растениями.
От слизняков на капусте
Для борьбы с нашествием слизней готовят простой порошок — стакан соды соединяют с половиной ведра золы. Им осыпают насаждения и почву вокруг них.
Отпугивание гусениц
Насекомые погибнут или уйдут с грядок, если их посыпать специальным составом. Здесь нужно смешать щелочной порошок с мукой в одинаковых пропорциях.
Отпугивание муравьев
Если на участке много муравьев, то кальцинированная сода поможет прогнать их. Она используется не в чистом виде, а с золой один к одному. Смесь насыпают на места обитания насекомых.
Полезное видео
Подробно о каждом растении на вашей даче, как лечить и вырастить замечательный урожай, смотрите видео
Где купить бельевую соду
Кальцинированная сода для применения в быту продается в магазинах в отделе бытовой химии. Иногда ее можно найти в торговых точках, предлагающих широкий ассортимент строительных материалов.
Обычно она расфасована в пачки по 500 г, но встречаются и более мелкие фасовки — по 100 г.
— эффективный способ.
Как приготовить едкий натр
Чистота соды
Чем выше процент, тем чище сода. Чда — это не производитель, а квалификация. Есть еще ч — чистый, хч — химически чистый и осч — высшая очистка.
Гост у чда — 4328-77 (конечные цифры — это год принятия госта), и по анализу эта сода чда — 99%, но считается все равно не самой чистой. (У соды ч очистка 99,9%, у хч — 99,99%…).
Если нет готового едкого натра или калия, можно приготовить:
- первый из кальцинированной или кристаллической соды и гашеной извести,
- а второй— из поташа и гашеной извести.
Едкий натр. На 1 кг кальцинированной соды, или на 2,85 кг кристаллической соды, берут 900 г гашеной извести. Приготовляют раствор соды крепостью при 30° С в 23° Б, для чего 1 кг соды растворяют в 4,5—4,6 л воды.
Раствор соды помещают в котел или соду сразу растворяют в котле для варки, нагревают жидкость до 60 С и небольшими порциями вливают смешанную с водой гашеную известь — «известковое молоко». При этом раствор очень пенится и может перейти через край. Поэтому котел нужно загружать только на 2/3 его вместимости и во время варки усиленно размешивать жидкость.
Чем тщательнее будет размешана жидкость, тем лучше произойдет процесс превращения обыкновенной соды в каустическую (едкий натр).
Смесь нужно нагревать 40—60 мин, затем ей дают отстояться и прозрачный раствор сливают с осадка.* Прозрачная жидкость — раствор едкого натра приблизительной крепости в 20°—21° Б, а в осадке остается часть нерастворившейся извести, остатки едкого натра, мел и другие примеси.По удалении прозрачного раствора к осадку можно прибавить воды,вскипятить несколько раз, дать отстояться и вновь слить прозрачную жидкость, которая также будет представлять собой раствор едкого натра, но значительно меньшей крепости.
При таком изготовлении едкого натра раствор получается в20°—21° Б. Если для омыления жира, из которого предполагают сделать мыло, нужна более крепкая щелочь, полученный раствор можно выпарить; по испарении воды раствор будет крепче. Если нужна щелочь меньшей крепости, раствор разбавляют водой.
При таком домашнем изготовлении едкого натра (каустической соды) из 1 кг кальцинированной соды получается 780—820 г каустической соды.
Выше указывалось, что кальцинированной соды нужно взять 1 кг, а кристаллической — 2,85 кг. Разница между кальцинированной и кристаллической содой заключается в том, что в последней находится кристаллизационная вода.
Если кристаллическую соду прокалить, она с треском рассыпается и превращается в белый порошок, уже совершенно лишенный воды(кальцинированный).
Едкий калий. Едкий калий приготовляется по тому же способу, как и едкий натр.На 1 кг кальцинированного поташа берут 6,8—7 кг гашеной извести и10—11 л воды. Раствор поташа в воде нагревают, не доведя до кипения, и маленькими порциями добавляют в котел гашеную известь, смешанную с водой (известковое молоко). Жидкость все время усиленно размешивают и нагревание продолжают 40—60 мин. Затем смеси дают отстояться, сливают прозрачную жидкость, представляющую собой раствор едкого калия приблизительной крепости в 16—17° Б, а осадок опять обливают водой,нагревают до кипения, дают отстояться и прозрачную жидкость, представляющую собой значительно меньшей крепости раствор, сливают.
Поташ можно приготовить домашним образом — извлечением его (выщелачиванием)из золы растений, из золы, получающейся при сжигании дров, и вообще из всякой древесной или растительной золы. Золу помещают в сосуд,имеющий в дне отверстие, слегка утрамбовывают и наливают на золу воду.Вода будет просачиваться через золу и вытекать из отверстия в дне в виде мутной жидкости, которую собирают в отдельный сосуд. Затем мокрую золу удаляют, насыпают свежей золы, которую обливают полученной мутной жидкостью из смоченной первой золы. Такую операцию повторяют до тех пор, пока одна и та же вода, пропущенная через несколько порций золы,не сделается густой. Густую жидкость пропускают для очистки от твердых частиц через редкую ткань и нагревают в глубокой железной сковороде до испарения воды.
По испарении воды на дне и стенках сковороды останется серая накипь,которую собирают в другой сосуд. Собранную накипь прокаливают при сильном огне на сковороде и получают белый порошок — поташ.
Калиевую щелочь можно также приготовить из растительной или древесной золы следующим образом: просеянную через сито золу складывают кучами на утрамбованном земляном или каменном полу и обливают ее небольшим количеством воды, чтобы она сделалась влажной. Затем в кучах проделывают углубления, насыпают приблизительно 8—10% негашеной извести, наливают, все хорошо перемешивают и, когда известь вся погасится, ее обсыпают сверху золой. Охлажденную и хорошо перемешанную массу помещают в чан с двумя днищами, из которых верхнее имеет много мелких отверстий. На верхнее дно кладут кусок грубой холстины и насыпают смесь золы с известью. Между обоими днищами с одной стороны делают отверстие, в которое вставляют трубку для отвода воздуха, а в противоположной стороне приделывают кран для спуска щелока. На золу с известью наливают теплую воду, хорошо смешивают и дают отстояться 6—8часов. После этого через кран выпускают щелок, имеющий приблизительно крепость в 20—25° Б.
Второе обливание воды даст щелок крепостью в 8—10° Б, третье — в 4—2° Б.

 (
(