Обзор картриджей и засыпок с ионообменной смолой
В проточных фильтрах и станциях умягчения воды в качестве основного фильтрующего материала используют ионообменную смолу. Есть несколько ее разновидностей, но чаще всего речь идет про катиониты. Т.е. те смолы, которые обменивают катионы тяжелых металлов из исходной воды на ионы натрия или калия.
Если интерес представляют лишь конкретные картриджи и засыпки <– перейдите по ссылкам.
Состав
За ионный обмен отвечают ионогенные комплексы. В случае с катионитами это кислотные группы. Основой для них служат сферические гранулы из полимеров стирола и акриловой кислоты. Внешне такой материал выглядит как мелкозернистая рыбная икра белого, желтого, янтарного, коричневого или черного цвета.
 Неоднородность цвета в большинстве случаев обусловлена разной влажностью
Неоднородность цвета в большинстве случаев обусловлена разной влажностьюХарактеристики
| Label 1 | Label 2 |
|---|---|
| Физическая форма | Сферические гранулы белого, желтого, черного или другого цвета. |
| Ионная форма | Обычно Na+, но бывает и K+. Показывает то, какими катионами смола будет обмениваться перед первой регенерацией. |
| Общая обменная емкость | Определяет максимальный объем воды, который способен умягчить литр смолы. Выражается в эквивалент/литр. Чем выше, тем лучше. Обычно равна 1,9-2 экв/л. |
| Диапазон pH | Допустимое значение pH для нормальной работы материала. Самые популярные катиониты работают во всем диапазоне при pH(0-14). |
| Максимальная температура воды | Обычно равна 120-150°C. Учитывая то, что в быту обычно умягчают холодную воду, этим свойством можно пренебречь. |
| Влагосодержание | Смола всегда должна находиться в увлажненном состоянии. Содержание влаги может составлять от 43 до 50%. Если упаковка вскрыта, то этот параметр будет низким – такой материал непригоден, т.к. его обменная емкость будет ниже паспортной. |
| Насыпная масса | Этот параметр помогает понять, сколько материала поместится в картридж или фильтрующую колонну. |
| Средний размер гранул | Чем однороднее состав, тем более предсказуемым будет результат. Лучше всего материал с разбежкой 0,2-0,3 мм, например, со средним размером гранул 0,6-0,8 мм. |
| Содержание мелких гранул (меньше 0,3 мм) | Чем меньше, тем лучше – ниже вероятность, что их вымоет в канализацию или в очищенную воду. Нормальным считается значение до 1%. |
| Чем больше, тем хуже – меньше совокупная поверхность гранул, вступающая в реакцию ионного обмена. Нормальным считается значение до 5%. |
| Label 1 | Label 2 |
|---|---|
| Скорость потока в рабочем режиме | Определяет скорость движения воды через фильтрующий материал. Указывается в виде диапазона. В среднем это 10-25 м/c, но бывают и более широкие разбежки для максимальной и минимальной скорости. |
| Высота слоя материала | Минимальная высота слоя, обеспечивающая качественную водоподготовку при указанных скоростях потока. Определяет то, насколько много засыпки требуется для наполнения колонны. Обычно высота составляет минимум 0,6 м. |
| Расширение | В рабочем режиме загрузка находится в состоянии кипящего слоя, т.е. исходный материал парит в потоках воды, что отражается показателем расширения в %. Обычно это 25-50% в зависимости от скорости потока. Исходя из этого рассчитывают размер колонны и количество засыпки. |
| Регенерант | Соль для приготовления регенерирующего раствора. Чаще всего используют таблетированную поваренную соль (NaCl). |
| Доза регенеранта | Количество соли для восстановления 1 л фильтрующего материала. Чем меньше, тем лучше. Нормальным считается расход в пределах 100-300 г/л. |
| Скорость потока регенеранта | Скорость, с которой происходит промывка смолы раствором соли. Чем выше, тем быстрее процессы. Варьируется в пределах от 1 до 12 м/ч. |
Принцип работы
 Как работает ионный обмен в случае с катионитами и жесткой водой
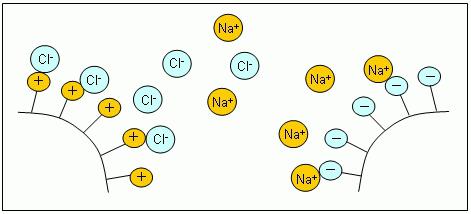
Как работает ионный обмен в случае с катионитами и жесткой водойВода содержит некоторое количество ионов жесткости, т.е. кальция и магния. При пропускании через смолу они замещают катионы натрия, которые и поступают в умягченную воду. Меньше солей жесткости – больше солей натрия. Всем хорошо!
Реакция обратима, на чем и основана технология регенерации (восстановления) такого фильтрующего материала.
Регенерация
Нужно взять поваренную соль без каких-либо добавок и приготовить 30% раствор. Например, в 1 литр добавить стакан соли. Тут точность особо не важна. Соль должна полностью раствориться, поэтому можно использовать теплую воду, которую потом остудить до комнатной температуры.
А вот сколько выдерживать в такой воде, тут мнения разделяются.
 Из инструкции Гейзер
Из инструкции Гейзер  Из инструкции Аквафор Трио
Из инструкции Аквафор Трио  Из инструкции Аквафор Кристалл
Из инструкции Аквафор КристаллЯ рекомендую оставить это дело восстанавливаться с вечера до утра – вся емкость смолы должна вернуться.
Регенерация для самых жадных
Если картридж со смолой используется долго и пережил несколько регенераций солевым раствором. Если вы чувствуете, что как-то он не очень работает, и уже через неделю опять появляется накипь в чайнике. То все это говорит о том, что он хочет на покой. Но мы его так просто не отпустим.
Гипотетически гранулы могут покрыться налетом, препятствующим нормальному протеканию восстановительных процессов. Соответственно его нужно чем-то растворить. Будем использовать слабую кислоту.
В 1,5 литрах теплой воды растворите 50 г лимонной кислоты. Оставьте на время, чтобы температура опустилась до комнатной. Этим раствором необходимо залить смолу на 2-3 часа и оставить в покое. Потом промыть чистой водой и попробовать восстановить солевым раствором, как обычно.
Срок службы
Средний срок службы в зависимости от интенсивности использования фильтрующего материала составляет 3-5 лет. Это объясняется механическим истиранием гранул, постепенным вымыванием мелких частиц ионообменной смолы. При неправильной эксплуатации она может испортиться и на первом году, в идеальных условиях – прослужит до 10 лет.
Вред
Можно ли пить воду после ее очистки ионообменными смолами? Если говорить про обычные бытовые случаи умягчения жесткой воды, то можно, ведь именно для этого эти смолы и производят. Другое дело, что количество натрия в питьевой воде регламентируется тем же СанПиН 2.1.4.1074-01. По этим нормам натрий в воде относится ко 2-му классу опасности, т.е. это высокоопасное вещество.

Какие-то соли натрия есть в исходной воде, а если учесть и те, которые будут поступать из смолы в процессе умягчения воды, то можно предположить следующее:
Если умягчать очень жесткую воду (жесткость от 7 мг*экв/л и выше) таким способом, то натрия там будет реально много. Сколько именно? А давайте посчитаем!
Для упрощения предположим, что жесткость обусловлена только присутствием солей кальция. Обычно их больше, чем соединений магния, так что все нормально.
1 мг-экв/л = 20,04 мг/л Ca2+
У нас жесткость 7 и выше, принимаем равной 7.
Получается, что в этом случае в 1 л. воды будет содержаться около 140 мг солей кальция.
Считаем, сколько это моль: 0,14/40=0,0035 моль
Учитывая валентность, на обмен поступит в 2 раза большее количество натрия или 0,007 моль.
Считаем массу ионов натрия: 0,007*23=0,161 г или 161 мг.
Т.е. при верхнем пороге жесткости по действующему СанПиН количество натрия лишь приблизится к максимально допустимому его содержанию. Здоровые люди могут быть спокойны.
В то же время переизбыток солей натрия способен вызывать отеки вследствие задержки жидкости, вызывает повышение давления, провоцирует заболевания почек, печени, желудка, поджелудочной.
свойства, принцип работы и классификация
Содержание статьи:
Ионообменные смолы – это соединения, которые не растворяются на высокомолекулярном уровне и способны выдать реакцию при взаимодействии с ионными элементами раствора. Иониты обладают трехмерной гелевой либо макропористой структурой. Применяются смолы для очищения, умягчения и обессоливания воды.
Классификация смол
Подобные составы подразделяются на катионообменные, анионообменные, биполярные.
Катионообменные соединения могут быть слабокислотными и сильнокислотными. Последние способны обмениваться катионами не зависимо от уровня рН. Первые работают только при показателе не ниже 7.
Анионообменные составы бывают сильноосновными и слабоосновными. Первые аниониты обладают свойством обмена анионами в растворах при любых значениях рН, чего не могут слабоосновные аниониты. Для них показатель должен составлять от одного до шести. Также встречаются аниониты промежуточной и смешанной активности.
Свойства и принцип работы
 Ионообменные смолы – нерастворимые полиэлектролиты. Многозарядный ион неподвижен ввиду большой молекулярной массы. Он является основой ионита, связан с малыми подвижными элементами с противоположным значением, и, в свою очередь, может обменивать их в растворе.
Ионообменные смолы – нерастворимые полиэлектролиты. Многозарядный ион неподвижен ввиду большой молекулярной массы. Он является основой ионита, связан с малыми подвижными элементами с противоположным значением, и, в свою очередь, может обменивать их в растворе.
При прохождении фильтрации жидкости через смоляной фильтр, она очищается:
- от опасных химических примесей;
- от калия и магния, образующих накипь;
- от солей тяжелых металлов, соединений железа.
Принцип работы фильтрационных устройств с ионообменной смолой направлен на очищение и улучшение качеств жесткой воды. Смоляные полимерные шарики изначально включают в состав «свободные» ионы, которые способны улавливать ионные частицы иных веществ.
Фрагменты ионообменной смолы набухают в процессе взаимодействия с водным потоком. Величина шарообразных полимеров может достигать 4 мм.
Жидкость, отдавая ионы тяжелых металлов и вредных компонентов, взамен получает нейтральные соединения.
Помимо гелиевых, существуют макропористые иониты. Их достоинствами являются незначительное изменение объема, лучшая адсорбция, продолжительность обменных процессов, ускоренная фильтрация.
Сфера применения

Ионообенная фильтрация применяется в промышленности и в быту
Благодаря смягчающему и обессоливающему эффекту ионообменные смолы для очистки технической воды применяют в теплоэнергетической и химической индустрии. В гидрометаллургической отрасли их используют для работы с цветными и редкими металлами. Иониты также способны очищать канализационные водоемы. Нередко используются аниониты в аквариумной водоподготовке – они содействуют созданию комфортных жизненных условий для рыб и растений.
В быту у ионообменных фильтров много полезных свойств:
- не образуется накипь на сантехнических устройствах и нагревательных узлах бытовых приборов, котле либо газовой колонке;
- уменьшается ломкость волос и сухость кожного покрова, пропадает перхоть;
- в три раза снижается расход моющих составов;
- со смесителей и кранов уходит серый и ржавый налет.
Если на электротэне не образуется накипь, это заметно снижает потребление электричества.
Бытовое использование ионообменных смол не представляет опасности, поскольку эти вещества не токсичны. Они не обладают тенденцией к самовоспламенению, не взрываются. Фильтрующие элементы с такими смолами монтируют перед котлом, бойлером либо водонагревателем проточного типа.
Критерии выбора
Ионообменные смолы можно найти в тех магазинах, где продают товары для водоподготовки, либо во Всемирной сети.
При выборе надо обращать внимание на такие характеристики:
- Влажность. В составе имеется химически связанная влага. Если от нее избавится, это приведет к разрушению ионообменной смолы.
- Емкость ионов. Она бывает рабочей, объемной, весовой. Последние два показателя – стандартные, их определяют в лабораторных условиях. Их значения прописаны в сопроводительной документации. Узнать объем рабочей емкости не получится, поскольку ее показатели определяются в зависимости от формы и глубины фильтрующего слоя смолы. Так же немаловажны вводные характеристики очищаемой жидкости.
- Скорость фильтрации и уровень регенерации, а также величина улавливаемых примесей.
Для бесперебойного очищения и продуктивности фильтров, картриджи рекомендовано заменять как минимум один раз на протяжении четырех-шести месяцев.
Особенности упаковки и хранения

Наполнители фасуют в полиэтиленовые пакеты
В соответствии с ГОСТом 20301-74 ионообменные смолы пакуют в мешки из полиэтилена. Максимальный вес одной упаковки может доходить до 50 кг. Также эти компоненты разрешено расфасовывать в бидоны либо контейнеры из пропилена.
Средняя стоимость ионообменной смолы в России равняется 120–150 рублям за литр.
В процессе перевозки либо хранения нахождение смоляных катионитов рядом с анионитами, любыми окисляющими веществами либо растворителями недопустимо.
Хранение продукции разрешено лишь в сухих помещениях с хорошей вентиляцией и температурным режимом не менее двух градусов тепла. Складывать упаковки разрешается на расстоянии больше метра от приборов, отапливающих помещение. Срок годности смол – 12 месяцев.
Восстановление ионообменной смолы
Фильтрующие элементы с ионообменной смолой для индустриального либо домашнего умягчения воды требуют систематических замен картриджа. Экономнее регулярно досыпать регенерационную соль. Подобные меры не являются трудозатратными, но при этом их производительность не так высока. К тому же надолго так фильтр не реанимируешь – для эффективного смягчения потребуется полностью заменить наполнитель.
Просто засыпать гравийную подушку и фильтрующую загрузку не составляет особого труда, но выгрузка отработанного наполнителя – задача не из легких. Особенно если резервуар фильтрационного устройства выполнен из стеклопластика и не оснащен сливной системой. Отсоединив его от водопровода, и демонтировав управляющий клапан, потребуется приложить серьезные усилия, чтобы перенести массивный фильтр из дома на улицу.
Если это удалось, производят выгрузку. Для этого надо:
- Фильтрующий элемент положить на бок на ровную поверхность.
- К вводной части трубки для подъема воды хомутом присоединить укрепленный шланг для подачи через него воды под определенным напором.
- Промыть потоком воды взрыхленный наполнитель.
- После полного освобождения емкости из умягчителя либо фильтрующего элемента удалить водоподъемную трубку.
- После этого выполнить вторичную промывку резервуара и занести его обратно в дом.
Существуют организации, специализирующиеся на обслуживании водоочистных систем. Самостоятельный подбор фильтрующего элемента для воды тоже бывает проблематичным. При выборе дорогостоящего оборудования лучше прибегнуть к помощи специалиста.
Оптимальным решением станет обращение в организацию, занимающуюся монтажом фильтрующих устройств, и предоставляющую полный спектр услуг. Это может быть профессиональное консультирование, проведение анализа воды из скважины либо колодца, помощь в выборе подходящего оборудования, доставка и монтаж прибора, а также сервисное обслуживание.
применение. Насколько они эффективны при очистке воды?
Ионообменные смолы – это нерастворимые на высокомолекулярном уровне соединения, которые могут показать реакцию при взаимодействии с ионами раствора. Они имеют трехмерную гелевую или макропористую структуры. Их еще называют ионитами.
Разновидности
 Эти смолы бывают катионообменными (делятся на сильнокислотные и слабокислотные), анионообменными (сильноосновные, слабоосновные, с промежуточной и смешанной основою) и биполярными. Сильнокислотные соединения – это катиониты, которые могут обмениваться катионами вне зависимости от показателей рН. А вот слабокислотные могут функционировать при значении не ниже семи. Сильноосновные аниониты имеют свойство обмениваться анионами в растворах при любой степени диссоциации, при любых показателях рН. Этого, в свою очередь, лишены слабоосновные аниониты. В этой ситуации рН должен быть 1-6. Другими словами, смолы могут обменять ионы в воде, впитать одни, а взамен отдать те, которые ранее были запасены. А так как именно H2O – многокомпонентная структура, то нужно верно ее подготовить, выбрать химическую реакцию.
Эти смолы бывают катионообменными (делятся на сильнокислотные и слабокислотные), анионообменными (сильноосновные, слабоосновные, с промежуточной и смешанной основою) и биполярными. Сильнокислотные соединения – это катиониты, которые могут обмениваться катионами вне зависимости от показателей рН. А вот слабокислотные могут функционировать при значении не ниже семи. Сильноосновные аниониты имеют свойство обмениваться анионами в растворах при любой степени диссоциации, при любых показателях рН. Этого, в свою очередь, лишены слабоосновные аниониты. В этой ситуации рН должен быть 1-6. Другими словами, смолы могут обменять ионы в воде, впитать одни, а взамен отдать те, которые ранее были запасены. А так как именно H2O – многокомпонентная структура, то нужно верно ее подготовить, выбрать химическую реакцию.Свойства
Ионообменные смолы — полиэлектролиты. Они не растворяются. Многозарядный ион неподвижен, потому что имеет большую молекулярную массу. Он образует основу ионита, связан с небольшими подвижными элементами, которые имеют противоположный знак, и, в свою очередь, может обменивать их в растворе.

Производство
Если полимер, который не имеет свойства ионита, обработать химически, то произойдут изменения – регенерация ионообменной смолы. Это достаточно важный процесс. С помощью полимераналогичных превращений, а еще поликонденсации и полимеризации, получают иониты. Существует солевая и смешанно-солевая формы. Первая подразумевает натриевый и хлористый, а вторая – натрий-водородный, гидроксильно-хлоридный виды. В таких условиях выпускаются иониты. Мало того, в процессе они переводятся в рабочую форму, а именно водородную, гидроксильную и т. д. Такие материалы используют в разных сферах деятельности, например, в медицине и фармацевтике, в пищевой промышленности, на атомных электростанциях для очистки конденсата. Также может применяться ионообменная смола для фильтра смешанного действия.
Применение
Используется ионообменная смола для умягчения воды. Кроме того, соединение может и обессолить жидкость. В связи с этим ионообменные смолы часто используют в теплоэнергетике. В гидрометаллургии ими пользуются для цветных и редких металлов, в химической промышленности ими очищают и разделяют разные элементы. Иониты также могут очистить сточные водоемы, а для органического синтеза они — целый катализатор. Таким образом, ионообменные смолы могут быть использованы в разных отраслях.
Промышленная очистка
На теплопередающих поверхностях может появляться накипь, а если она достигнет всего 1 мм, то расход топлива увеличится на 10%. Это все-таки большие потери. Мало того, оборудование быстрее изнашивается. Чтобы это предотвратить, нужно правильно организовывать водоподготовку. Для этого используется фильтр с ионообменной смолой. Именно очистив жидкость, можно избавиться от накипи. Способы бывают разные, но с повышением температуры их вариантов становится меньше.
Обработка H2O
Существует несколько способов для того, чтобы очистить воду. Можно воспользоваться магнитной и ультразвуковой обработкой, а можно отретушировать ее комплексонами, комплексонатами, ИОМС-1. Но более популярным вариантом считается фильтрация с помощью обмена ионов. Это заставит изменить состав элементов воды. Когда используют такой метод, H2O почти полностью обессоливается, загрязнения пропадают. Следует отметить, что такой очистки достаточно сложно добиться иными способами. Обработка воды с помощью ионообменных смол очень популярна не только в России, а и в других странах. Такая очистка имеет много достоинств и намного эффективнее прочих методов. Те элементы, которые удаляются, никогда не останутся осадком на дне, а дозировать реагенты не нужно постоянно. Сделать эту процедуру очень легко — конструкция фильтров однотипная. При желании можно воспользоваться автоматизацией. После очистки свойства будут сохраняться при любых колебаниях температуры.
Ионообменная смола Purolite A520E. Описание

Чтобы поглощать нитрат-ионы в воде, была создана макропористая смола. Она используется, чтобы очистить H2O в разных средах. Специально для этого появилась ионообменная смола Purolite A520E. Она способствует избавлению от нитратов даже при большом количестве сульфатов. Это значит, что, по сравнению с другими ионитами, эта смола наиболее эффективна и имеет лучшие характеристики.
Рабочая емкость
Purolite A520E имеет высокую селективность. Это помогает, вне зависимости от количества сульфатов, удалить нитраты качественно. Такими функциями не могут похвастаться остальные ионообменные смолы. Это обусловлено тем, что при содержании сульфатов в H2O снижается обмен элементами. Но благодаря селективности для Purolite A520E такое понижение не имеет особого значения. Хотя соединение имеет низкий, если сравнивать с другими, полный обмен, жидкость в больших количествах очищается достаточно качественно. При этом, если сульфатов будет мало, то справиться с обработкой воды и устранением нитратов смогут различные аниониты — как гелевые, так и макропористые.
Подготовительные операции
Чтобы смола Purolite A520E работала на 100%, она должна быть правильно подготовлена для выполнения функции очищения и подготовки H2O для пищевой индустрии. Следует отметить, что перед началом работы используемое соединение обрабатывают 6%-м раствором NaCl. При этом используют в два раза больший объем по сравнению с количеством самой смолы. После этого соединение обмывают пищевой водой (количество H2O должно быть в 4 раза больше). Только проведя такую обработку, можно приниматься за очистку.
Заключение
Благодаря свойствам, которыми обладают ионообменные смолы, ими можно пользоваться в пищевой индустрии не только для очистки воды, но и для обработки продуктов, различных напитков и прочего. На вид аниониты – это маленькие шарики. Именно к ним прилипают ионы кальция и магния, а они, в свою очередь, отдают ионы натрия в воду. В процессе промывки гранулы отпускают эти прилипшие элементы. Следует помнить о том, что в ионообменной смоле может упасть давление. Это скажется на ее полезных свойствах. На те или иные изменения влияют внешние факторы: температура, высота столбца и размер частиц, их скорость. Поэтому при обработке следует поддерживать оптимальное состояние среды. Часто пользуются анионитами в очистке воды для аквариума – они способствуют формированию хороших условий для жизни рыб и растений. Итак, ионообменные смолы нужны в разных индустриях, даже в домашних условиях, так как могут качественно очистить воду для дальнейшего ее использования.
Ионообменная смола — Каталог статей
Начнем с того, что у вас возникла необходимость в умягчении воды. По косвенным признакам или путем проведения химического анализа, что является более правильным, вы определили, что у вас жёсткая вода, которая требует умягчения.
Изучая фильтры для жесткой воды, вы обнаружили, что в большинстве своем они умягчают воду за счет использования ионообменных смол.
Что же это такое — ионообменная смола?
Первый секрет, который мы откроем, это то, что собственно к смоле ионообменные смолы никакого отношения не имеют. Ионообменные смолы изготавливаются из твердых, нерастворимых в воде синтетических полимеров.  Внешне ионообменная смола очень похожа на икру щуки, так как состоит из гранул-«шариков» диаметром от 0,2 до 1,2 мм.
Внешне ионообменная смола очень похожа на икру щуки, так как состоит из гранул-«шариков» диаметром от 0,2 до 1,2 мм.
Ионообменная смола может быть монодисперсной, то есть «шарики» в ней будут одного размера и полидисперсной с различным размером гранул. Этот фактор влияет на скорость и степень очистки воды, а так же спектр удаляемых загрязнений.
Ионообменные смолы применяются для удаления из воды солей жесткости, растворенных металлов и органических соединений с 60-х годов XX века, но наиболее широкое распространение получили в конце 80-х — в 90-х годов.
Ионообменные смолы представляют собой нерастворимые высокомолекулярные соединения с функциональными ионогенными группами, способными вступать в реакции обмена с ионами раствора. Проще говоря, смола способна задерживать ионы различных примесей, меняя их на безопасные и безвредные ионы других веществ. Таким образом осуществляется ионный обмен — отсюда и обобщающее название этих смол — «ионообменные» или же «иониты»*.
*Свойства ионитов задерживать и заменять ионы так же использованы в ионитном субстрате ЦИОН.
Виды ионообменных смол
Видов ионообменных смол огромное множество: для удаления железа, марганца, для удаления органики с помощью МИКСОВ (смесей), селективные смолы (которые удаляют в первую очередь конкретные элементы: нитраты, бор, кремний и т.д.).
В бытовых условиях ионообменные смолы в основном применяются для удаления солей жесткости (соли кальция, магния) путем натрий-катионирования. Этот процесс называется умягчением воды или ионным обменом, катионированием.
Именно на этих смолах мы остановимся подробнее, так как они работают за счет регенерации солью NaCl, что возможно сделать в бытовых условиях. Другие смолы нужно регенерировать агрессивными веществами, поэтому их применяют в основном на производствах. Есть смолы для глубокой очистки воды. Они работают на истощение. Их не регенерируют, а просто меняют смолу на новую.
Суть процесса умягчения
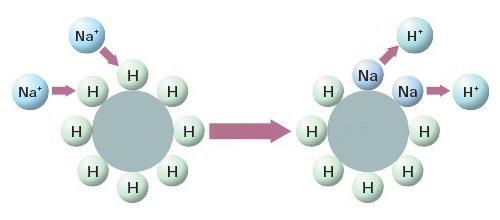
В первую очередь нужно понять, что умягчение принципиально отличается от обезжелезивания. При обезжелезивании происходит окисление и перевод растворенных веществ в твердую форму для последующего фильтрования. При умягчении ионообменная смола (Na-катионит) забирает из раствора положительно заряженные ионы (диссоциированные соли) кальция, натрия, железа, марганца и т.д. и замещает их на катионы натрия.
Таким образом мы избавляемся от проблем, которые возникают при использовании жёсткой воды:
- Белые следы от высохших капель и белый налет на сантехнике.
- Сухость, ощущение стягивания кожи после мытья, ломкость волос, ногтей.
- Накипь на нагреваемых поверхностях — известковый осадок в виде песка, известковые наросты, камни различной степени прочности, от которых страдает бытовая техника: чайники, стиральные машины, паровые приспособления, душевые лейки.
- Высокая жёсткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения.
Хотя правильнее будет говорить не жёсткость, а концентрация жёсткости. Потому что в природной воде и в воде из-под крана (в любой воде, не прошедшей через специальные фильтры или специальную обработку) всегда есть какой-либо уровень жёсткости. Концентрацию жёсткости дают растворенные в ней соли. Накипь на чайнике — это отложения именно тех самых растворенных солей.
Как работает ионообменная смола?
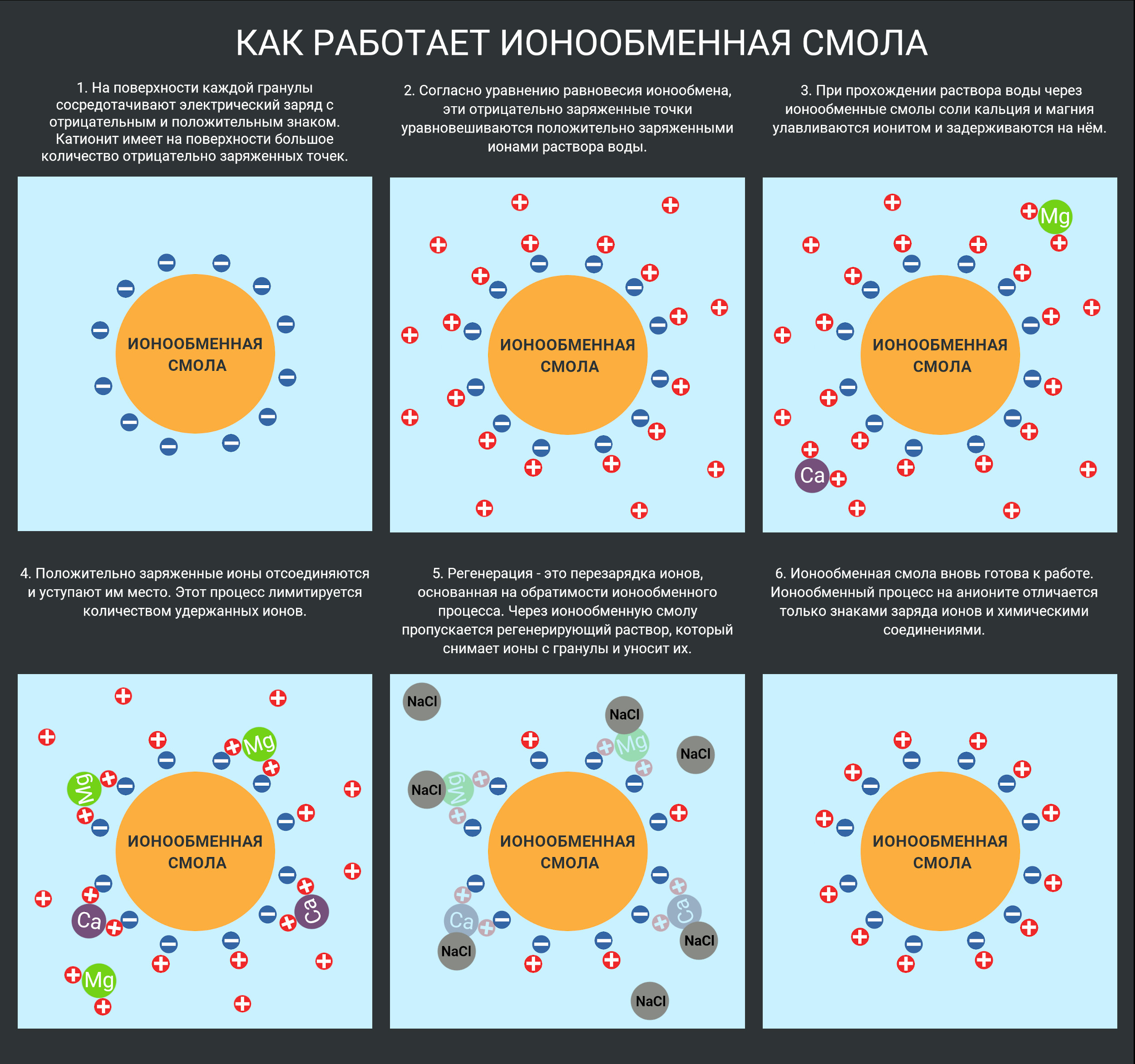
- На поверхности каждой гранулы сосредотачивают электрический заряд с отрицательным и положительным знаком. Катионит имеет на поверхности большое количество отрицательно заряженных точек.
- Согласно уравнению равновесия ионообмена, эти отрицательно заряженные точки уравновешиваются положительно заряженными ионами раствора воды.
- При прохождении раствора воды через ионообменные смолы соли кальция и магния улавливаются ионитом и задерживаются на нём.
- Положительно заряженные ионы отсоединяются и уступают им место. Этот процесс лимитируется количеством удержанных ионов.
- Далее происходит перезарядка ионов- регенерация, основанная на обратимости ионообменного процесса. Теперь через ионообменную смолу пропускается регенерирующий раствор, который снимает ионы с гранулы и уносит их.
- Ионообменная смола вновь готова к работе. Ионообменный процесс на анионите отличается только знаками заряда ионов и химическими соединениями.
Емкость ионообменной смолы
По своей сути, емкость ионообменной смолы сродни емкости аккумуляторной батарейки.
Ионообменная смола имеет некий запас натрия, который в процессе ионообменного обмена замещается ионами растворенных солей, тем самым снижая способность смолы забирать из воды растворенные вещества. Когда заканчивается натрий в смоле — прекращается и очистка, вода проходит через толщу смолы, не изменяя своих свойств.
Собственно этот запас натрия и определяет емкость смолы. Кроме того, емкость ионообменной смолы может постепенно снижаться из-за засорения смолы окисленным железом и взвешенными веществами.
Скорость фильтрации и производительность
На то, чтобы произошел ионообменный процесс необходимо время. Чем грязнее вода, чем больше в ней растворенных веществ, тем медленнее она должна проходить через смолу для хорошей очистки.
Казалось бы, гранулы ионообменной смолы — это гладкие шарики, но на самом деле их поверхность пористая. Стенки этих пор тоже являются рабочей поверхностью, на которой закреплен натрий, способный к обмену с кальцием и другими катионами. Чем мельче фракция смолы — тем больше ее рабочая поверхность и, соответственно, скорость обмена больше. А значит большее количество ненужных нам растворенных веществ задержится в смоле. Но при этом, чем смола мельче, тем хуже ее дренажные свойства, а значит скорость фильтрации воды будет ниже.
Фильтроцикл
Выбирая фильтр для очистки жесткой воды, нужно обязательно обратить внимание на ресурс умягчающего фильтроэлемента. Производители фильтров рассчитывают работу умягчителя таким образом, чтобы сделать регенерацию (промывку) смолы раствором поваренной соли до наступления ощутимого снижения качества очистки.
Последовательность стадий насыщения и регенерации ионообменной смолы называется фильтроциклом. Проще говоря — фильтоцикл — это количество полученной чистой воды между регенерациями. Например, фильтроэлементы Барьер Эксперт Смягчение и Барьер Профи Смягчение имеют ресурс 500 литров и производительность 2л/мин.
Например, фильтроэлементы Барьер Эксперт Смягчение и Барьер Профи Смягчение имеют ресурс 500 литров и производительность 2л/мин.
Производитель предупреждает о необходимости полной замены фильтроэлемента не реже, чем 1 раз в год и обязательном учёте жёсткость исходной воды.
Так, например при исходной жёсткости воды 5 мк-экв/л и среднесуточном потреблении питьевой воды 5 литров, вам нужно будет регенерировать фильтроэлемент 1 раз в два месяца. Если же исходная жесткость воды 10 мк-экв/л, то 1 раз в месяц.
Вот почему так важно перед покупкой фильтра сделать анализ воды, которую необходимо очищать. Информация о составе воды позволит вам подобрать оптимальный вариант очистки и избавит от ненужных трат.
Регенерация ионообменной смолы
В процессе эксплуатации фильтров для жёсткой воды, ионообменная смола начинает терять свои свойства, и чтобы вернуть её в первоначальное состояние, необходимо периодически её восстанавливать – запускать процесс регенерации.
При данной процедуре, взвешенные соли удаляются из фильтра промывкой водой. Ионы, связанные с ионообменной смолой, удаляются раствором регенерации (NaCl). Фильтр промывается водой, чтобы удалить раствор регенерации. Одно из достоинств фильтров на основе ионообменных смол состоит в том, что регенерация катионитов производится раствором обычной поваренной соли (хлористый натрий, NaCl). То есть на здоровье человека и состоянии экологии не оказывается никакого отрицательного воздействия.
Восстановление свойств фильтрующего реагента позволяет многократно использовать один фильтроэлемент. Однако, способность ионообменной смолы умягчать воду постепенно снижается, так как регенерация не возвращает ионообменной смоле все ее свойства на 100%.
Средний срок службы фильтроэлементов, содержащих ионообменную смолу, определяется производителем. Полностью выработанные катиониты подлежат утилизации.
Регенерация и восстановление ионообменных смол
Процесс очистки воды методом ионного обмена проходит в фильтрах ионообменного действия. В промышленных установках умягчения регенерация ионообменной смолы проводится автоматически с помощью клапанов управления, последовательно проходя стадии сорбции, регенерации и промывания. Аналогично этот процесс происходит в фильтрах умягчения для частных и загородных домов. Домашние фильтры картриджного типа необходимо промывать самостоятельно при утрате ионообменным материалом сорбционных свойств. Регулярность промывки ионообменной смолы зависит от качества поступающей воды, интенсивности использования фильтра.
Что такое ионообменная смола и где она применяется
Ионообменная смола представляет собой синтетическое органическое высокомолекулярное соединение, которое имеет в составе ионогенные группы, диссоциирующие в растворе и способные к обмену подвижных ионов на другие ионы, содержащиеся в водной среде. Свойства ионитов определяются природой функциональных групп:
- в анионитах: -NH3-, =NH2+, =N+=, =P+=, ≡S+;
- в катионитах: AsO32-, -COO, -PO32-, -SO32-.
Ионообменные смолы представляют собой мелкие зерна или гранулы разных геометрических параметров и размеров в зависимости от метода получения: при полимеризации получаются практически идеальные сферы, поликонденсационные смолы имеют гранулы неправильной формы. Размеры варьируются от нескольких микрон до 1,5 мм.
По структуре полимерной основы ионообменные смолы бывают гелевые (непористые) и изопористые. Величина обменной емкости ионита зависит от числа активных групп на поверхности зерен, размера пор, углублений, каналов в его структуре.
Ионообменные смолы применяют для деминерализации, умягчения, обескремнивания водных растворов, избирательного удаления определенных ионов. Применение ионитов в технологических процессах позволяет сократить трудоемкость многих операций, переводя их на непрерывный процесс, и получить конечные продукты в более чистом виде. Ионообменные фильтры используют в быту для получения мягкой воды, применяемой при приготовлении пищи, стирке, на другие хозяйственные нужды.
Как можно регенерировать ионообменную смолу
При насыщении смолы удаляемой группой ионов до проскока их в фильтрат происходит истощение ионита. Процесс восстановления первоначальной формы ионообменной смолы называется регенерацией.
В процессе водоподготовки по мере прохождения исходной воды через катионитовый слой, количество катионов Na+, способных к обмену, уменьшается, а число катионов Mg2+ и Ca2+, отсорбированных на смоле, увеличивается. Ионные процессы обратимы, поэтому по мере насыщения обрабатываемой воды Na+, замедляется поглощение ионов, обуславливающих жесткость, и ионообменная очистка теряет свою эффективность. Для этого и нужен процесс регенерации ионообменной смолы.
Полезная обменная емкость катионита зависит от:
- вида удаляемых из водного раствора ионов;
- соотношения солевых компонентов в водном растворе;
- величины рН;
- высоты катионитового слоя;
- скорости потока фильтруемой воды;
- интенсивности эксплуатации;
- расхода регенерирующего раствора.
После истощения катионита его отключают на регенерацию ионообменной смолы. В промышленных установках продолжительность восстановления фильтра с ионообменной смолой составляет примерно 1,5-2 часа:
- взрыхление 15 — 25 мин;
- фильтрование регенерата 20 — 25 мин;
- отмывание 40 — 50 мин.
Взрыхляют катионитовый слой восходящей струей исходной воды, отработанным раствором после регенерации ионообменной смолы или отмывочным водным раствором.
В домашних условиях восстановление картриджа с ионообменной смолой проводится выдерживанием ионообменной смолы в регенерирующем растворе в течение 8 — 10 часов при периодическом перемешивании. Частота промывки ионитового картриджа зависит от жесткости поступающей в него воды. Первым сигналом того, что ионит исчерпал свою обменную емкость, будет образование накипи на посуде при кипячении.
Чем регенерируют ионообменные смолы
Существует несколько реагентов для процесса регенерации ионообменной смолы
Соль таблетированная для регенерации ионообменных смол
В связи с доступностью и небольшой стоимостью хлорида Na, он стал основным реагентом для восстановления фильтров с ионообменными смолами, используемых при водоподготовке. Образующиеся после восстановления поваренной солью MgCl2 и CaCl2 полностью растворяются в воде, в отличие от CaCO3, образуемом при регенерации карбонатом Na, или CaSO4 при применении сульфата Na.
Процесс регенерации ионообменной смолы можно представить:
Ca[Кат]2 + 2NaCl ↔ 2Na[Кат] + CaCl2;
Mg[Кат]2 + 2NaCl ↔ 2Na[Кат] + MgCl2.
Раствор технической соли NaCl в промышленных установках пропускают сквозь натриевый ионит с интенсивностью 2 — 4 м/ч. Концентрация раствора NaCl составляет 6 — 9%. При жесткости фильтрата до 0,25 мг/л берут раствор с содержанием соли 6%, при жесткости меньше 0,06 мг/л предусмотрена поэтапная регенерация разбавленным 2 — 4% хлоридом натрия в пересчете 1,1 м3 раствора на 1 м3 катионита, затем более концентрированным 8 — 10% хлоридом Na. Регенерация ионообменных смол поваренной солью наиболее часто используется в промышленности.
Повышение температуры ускоряет диффузию ионов, поэтому рекомендуется нагревать умягчаемую воду и регенерирующий раствор до 35 — 45°С, если это допускает технологический процесс.
Восстановление ионообменной смолы кислотой и щелочью
Кроме раствора поваренной соли промывку ионообменной смолы проводят кислотой (соляной, лимонной и т.д.) или щелочь. Это необходимо для регенерации специальных ионообменных смол, которые применяются для деминерализии воды. Данный процесс должен проводиться под контролем специалистов.
Расчет соли для регенерации ионообменной смолы
Расход NaCl (кг) на один цикл регенерации натриевого катионита рассчитывают по формуле:
P=(V*a)/1000
где V — количество ионообменной смолы, л; a — расход NaCl на 1 г-экв полезной ионообменной емкости ионита (для одноступенчатой системы — 160 — 210 г/г-экв; для фильтра первого этапа в двухэтапной системе равен 130 — 160, второго этапа — 250 — 350 г/г-экв).
Как провести регенерацию ионообменной смолы
В промышленных установках ионообменной фильтрации, восстановление сорбционной способности фильтра заложено в технологический процесс работы оборудования. Методику восстановления ионообменной смолы можно описать четырьмя ступенями.
Прохождение водного раствора через катионитовый слой с интенсивностью 15 — 30 м/ч до появления установленной нормативным допуском жесткости в фильтрате.
- Взрыхление ионита восходящей струей исходной воды, отработанного регенерационного раствора или промывных вод со скоростью 2 — 5 л/(с*м2).
- Стравливание воздуха, чтобы избежать разбавления регенерата.
- Восстановление катионита посредством пропускания соответствующего раствора с интенсивностью 4 — 6 м/ч.
- Отмывание катионитового слоя исходной водой (скорость потока 8 — 10 м/ч).
Восстановление ионообменной смолы в домашних условиях
Регенерацию картриджей с ионообменной смолой бытовых фильтров можно проводить самостоятельно по мере их истощения с использованием технической поваренной соли. Также популярным вопросом является «Сколько регенерировать ионообменную смолу?». В зависимости от устройства фильтра, промывание проводится непосредственно в фильтрующем блоке или посредством регенерации ионообменной смолы в отдельном сосуде. Инструкция по регенерации ионообменной смолы:
- Необходимо снять картридж с ионообменной смолой из установки фильтра.
- Колбу фильтра нужно тщательно вымыть.
- Приготовить насыщенный раствор для регенерации смолы ионообменной NaCl из расчета 100 гр технической поваренной соли на 1 л теплой (40 — 45°С) воды (нельзя использовать йодированную соль).
- В разборных картриджах высыпать ионит в отдельную емкость, залить раствором соли, оставить на 7 — 8 часов, периодически перемешивая.
- При невозможности извлечь смолу, соляной раствор заливают прямо в картридж до заполнения (около 2 л). Картридж с катионитом помещают обратно в колбу, доливают приготовленный раствор (еще примерно 0,5 л) и оставляют на 8 — 10 часов.
- Извлеченный ионит промывают под проточной водой несколько раз и засыпают в емкость фильтра.
- Картридж вынимают из раствора соли, и остаток NaCl (около 2,5 л) проливают через него тонкой струей. Затем картридж промывается 2 — 2,5 л воды до исчезновения соленого вкуса.
- После сборки фильтра, нужно пропустить через него воду в течение 3 — 4 минут.
Регенерация или замена: сколько раз можно регенерировать ионообменную смолу
Необходимая глубина умягчения при фильтровании воды через катионитовый фильтр может быть достигнута только при правильно выбранных и точно рассчитанных параметрах его работы. Регенерацию можно проводить много раз, но после каждого восстановления степень умягчения воды будет снижаться. Когда смола перестала восстанавливать свои первоначальные обменные свойства, картридж или загрузка фильтра подлежит замене на новый.
Мы знаем все о регенерации смол ионного обмена
Мы предлагаем ионообменные фильтры для бытового использования и промышленные установки для умягчения воды разной конструкции и обменной емкости, а также техническую поваренную соль для осуществления своевременной регенерации ионообменной смолы. Получить подробную консультацию и сделать заказ можно по телефону или электронной почте. Оформление заказа также возможно через форму обратной связи на сайте.
Что такое ионный обмен и ионообменные смолы? ВИДЕО
Еще в 19-м веке люди стали замечать, что почва (земля) обладает способностью заменять одни вещества на другие. Данный феномен был изучен учеными по всему миру и были выявлены вещества способные обменивать одни ионы на другие. Так возникли иониты — материалы, способные изменять свойства воды.
Ионообменные смолы иначе называют ионитами — это твердые вещества, способные к ионному обмену при определенных условиях. Иониты, в простонародье называемые смолами удерживают на своей поверхности ионы одних веществ (например, натрия) и с легкостью отдают их, забирая взамен ионы других веществ, например металлов, различных солей, органических веществ.
Ионный обмен — химическая реакция, обратимая. При этой реакции происходит обмен ионами между ионитом и раствором электролита (раствором солей).
Основные принципы ионного обмена
Ионный обмен основан на использовании ионитов — сетчатых полимеров разной степени сшивки, гелевой микро- или макропористой структуры, ковалентно связанных с ионогенными группами. Обменивающиеся ионы называются противоионами. Иониты состоят из неподвижного каркаса — матрицы и функциональных групп — фиксированных ионов, которые жестко прикреплены к матрице и взаимодействуют с противоионами. В зависимости от знака заряда противоионов иониты делят на катиониты и аниониты. Если противоионы заряжены положительно, то они являются катионами (например, ионы водорода Н+ или ионы металлов), ионит называют катионитом. Если противоионы заряжены отрицательно, то есть являются анионами (например, ион гидроксила ОН- или кислотные остатки), ионит называют анионитом.
Кинетика ионного обмена
Кинетика ионного обмена определяет скорость протекания ионообменной реакции. На скорость ионного обмена влияют следующие факторы:
- доступность фиксированных ионов внутри каркаса ионита,
- размер гранул ионита,
- температура,
- концентрация раствора и т. д.
Общая скорость процесса ионного обмена может быть представлена как совокупность процессов, происходящих в растворе (диффузия противоионов к зерну и от зерна ионита) и в ионите (диффузия противоионов от поверхности к центру зерна ионита и в обратном направлении; обмен противоионов ионита на противоионы из раствора). В условиях, приближенных к реальным условиям очистки воды, доминирующим фактором, определяющим скорость ионного обмена, является диффузия ионов внутри зерна ионита. Следовательно, скорость ионного обмена, прежде всего, зависит от размера зерна ионита и увеличивается с уменьшением размера зерна. В зависимости от природы матрицы различают неорганические и органические иониты.
Кроме того, под ионным обменом подразумевают:
- Реакции и процессы разделения, выделения и очистки веществ, проводимые с применением ионообменных материалов: ионообменных смол, цеолитов, и др.
- Процессы обмена ионов между почвами и содержащейся в них (омывающей их) водой.
Видео об ионном обмене. Советский учебный фильм.
Рассказать друзьям
Ионный обмен как метод очистки воды
Ионный обмен воды относится к методам обессоливания водных растворов. В отличие от обычного фильтрования через зернистые материалы, когда состав водного раствора не меняется, фильтрование ионообменным методом очистки воды основано на направленном изменении ионного состава водного раствора путем пропускания его через мелкозернистые ионообменные материалы — иониты, которыми предварительно заполняют специальные резервуары — ионные фильтры. Полезная работа ионных фильтров, заключаемая в возможности осуществлять требуемый ионный обмен между ионитом и фильтруемым водным раствором, называется обменной емкостью ионитового материала.
Опреснение воды ионным обменом применяется для природных вод с величиной минерализации менее 1,5 — 2 г/л и общей концентрацией сульфатов и хлоридов не выше 5 мг/л, взвешенных примесей — до 8 мг/л, цветности воды — не более 30 град, перманганатной окисляемости — до 7 мг/л О2.
Ионный обмен как метод очистки воды
В основе механизма деминерализации воды ионным обменом лежит способность ионообменных смол избирательно забирать из электролита ионы металлов взамен на эквивалентное количество ионов ионита. На скорость процесса влияет валентность ионов, их заряд, степень гидратации, радиус иона. Реакция ионного обмена в воде:
Na+ < NH4+ < K+ < Ba2+ < Mg2+ < Ca2+ < Al3+ < Fe3+
В результате прохождения воды сначала через катионитовые, а затем ОН—, СО3- или НСО3- анионитовые фильтры подвижные ионы ионитов замещаются растворенными в воде анионами и катионами. Реакция ионного обмена между веществами и водой:
H[Кат] + NaCL ↔ Na[Кат] + HCL;
2H[Кат] + Na2SO4 ↔ 2Na[Кат] + H2SO4;
2H[Кат] + Ca(HCO3)2 ↔ Ca[Кат]2 + 2CO2↑ + 2H2O.
На рабочую обменную емкость катионитов существенно влияют анионный состав водного раствора и общее солесодержание, выражающееся отношением концентрации ионов НСО3– в воде к сумме концентраций ионов НСО3–, SO42–, CL–, NO3–.
Попадая в анионитовые фильтры, анионы образующихся кислот и находящиеся в исходном водном растворе обмениваются на подвижные ионы анионитов:
[Ан]2CO3 + H2SO4 ↔ [Ан]2SO4 + H2O + CO2↑;
[Ан]HCO3 + HCL ↔ [Ан]CL + H2O + CO2↑;
2[Ан]OH + H2SiO3 ↔ [Ан]2SiO3 + 2H2O.
Ионообменная обработка воды
Наиболее часто используют аниониты, в состав которых входят амино- и амониевые функциональные группы. Аниониты с первичными (-NH2), вторичными (=NH) и третичными (≡N) аминогруппами характеризуются слабоосновными, а четвертичные аммониевые группы (-N+Ra) — сильноосновными свойствами. Слабоосновные аниониты проявляют реакционную способность только в кислой среде, сильноосновные — в растворах с любой реакцией.
Катиониты и аниониты делят на моно- и полифункциональные. Монокатиониты, имеющие в составе сульфогруппу, относятся к сильнокислым, диссоциируют полностью и могут осуществлять ионный обмен в растворе с любым рН. Катиониты с карбоксильной и фенольной группами являются слабокислотными и могут активно работать лишь в щелочной среде. Фосфоросодержащие группы имеют среднее значение кислотности. Слабоосновные аниониты чаще бывают полифункциональными. Полезная обменная емкость анионитов повышается с понижением рН раствора.
В качестве ионитов применяют синтетические смолы, полученные путем полимеризации или поликонденсации. На скорость ионного обмена влияет быстрота диффузии ионов к границе раздела ионит — водный раствор. В компактных по структуре фильтрах процесс идет быстро и преимущественно на внешних слоях — экстрамицеллярный ионообмен, но при этом сорбционная емкость ионита задействована не в полном объеме. В пористых фильтрах величина капилляров больше диаметра гидратированных катионов и анионов, ионообмен проходит на внутренней стороне — интермицеллярный процесс. Он медленнее, но характеризуется большим сорбционным потенциалом.
Ионный обмен для очистки воды
Для деминерализации воды водный раствор, избавленный от основных примесей путем предварительной очистки, поступает последовательно в катионобменные и анионообменные фильтры. В катионите связываются ионы металлов, а в раствор уходят соответствующие кислоты. Образующийся СО2 удаляют дегазацией. Затем в анионите происходит сорбция сильнокислых анионов.
В зависимости от необходимой глубины очистки реализуются одно-, двух- и трехступенчатые ионообменные аппараты. Во всех установках ионообменной очистки воды для связывания катионов металлов из водного раствора применяют сильнокислотные катиониты с хорошей сорбционной способностью.
При непрерывной работе ионообменной установки независимо от количества ступеней очистки каждый цикл должен включать минимум два фильтра. Через ионитовый аппарат пропускают часть водного раствора, затем смешивают его с оставшейся водой и обеспечивают в деминерализованной воде концентрацию солей, отвечающую требованиям потребителя: для питьевого и хозяйственного использования оно должно составлять 0,5 — 1 г/л, при присутствии хлоридов не более 0,35, сульфатов — до 0,5 г/л.
Для получения водного раствора с общей минерализацией до 0,5 мг/л и одновременным обескремниванием его до 1 мг/л применяют установки с двухступенчатой схемой Н+ и ОН— ионирования. Если же содержание солей необходимо довести до 0,1 мг/л, а содержание кремниевой кислоты до 0,05 мг/л, используют трехступенчатое ионирование.
Основные цели применения ионообменного метода обессоливания воды
Наибольшее распространение ионообменный метод получил при умягчении водных растворов: избавлении их от растворенных Сa2+ и Mg2+, вызывающих нарастание накипи на оборудовании. Для этого используют Na-катионирование, H-Na катионовый метод, Na-CL ионирование воды. В результате ионообменной реакции Na замещает накипеобразующие Ca, Mg, образуя отлично растворимые в воде соли. Восстановление ионообменной способности смолы проводят хлоридом натрия.
Ионообменная очистка воды от железа
Обезжелезивание воды катионированием используют при необходимости одновременного удаления Fe и солей, обуславливающих жесткость, и когда обрабатываемый водный раствор на пути к катионитовому фильтру не обогащается кислородом. Вода проходит через фильтры, загруженные Na-катионитом. Регенерируют такой катионит NaCl.
2 Na[Кат] + FeSO4 ↔ Fe[Кат]2 + Na2SO4.
На Na и K катионитовых фильтрах эффективно удаляются из водных растворов ионы Mn2+ путем перевода их в соединения марганца (IV). Mарганец (II) окисляется KMnO4 до оксида Mn (IV), который пленкой осаждается на зернах катионита. Марганцевый катионит получают обработкой любого катионита в натриевой форме с дисперсностью 0,5 — 1,2 мм последовательным пропусканием 0,5% растворов MnCL2 и KMnO4. Формула ионного обмена в воде:
2Na[Кат] + MnCl2 ↔ Mn[Кат]2 + NaCl;
Mn[Кат]2 + 2Me+ + KMnO4 ↔ 2Me[Кат]2 + 2MnO2,
где Ме+ — ион К+ или Na+.
Подробнее про обработку воды ионным обменом в частных домах вы можете прочитать здесь!
Другое применение ионного обмена для очистки воды
Кроме комплексного удаления ионов, существуют селективные или монофункциональные иониты, направленные на поглощение определенного вида ионов (B—, F—, NO3—, редкоземельных и тяжелых металлов). Комплексообразующие ионообменные смолы преимущественно связывают ионы, способные к образованию координационной связи с определенными элементами, входящими в состав селективных ионитов.
Метод ионного обмена для получения воды очищенной
Соединение в одной установке смешанного действия анионита и катионита позволяет достигнуть высокой чистоты раствора: за один цикл удаляются практически все растворенные ионы. Получаем чистую воду с низкой минерализацией и нейтральным рН. Избирательно подобранные по размеру и плотности зерна монодисперсных ионитов в современных фильтрах обеспечивают качественное связывание и стабильность параметров. Такие установки ионного обмена воды не регенерируются и подлежат замене при выработке ионообменной емкости.
Преимущества очистки воды с помощью ионного обмена
Метод ионного обмена при очистке воды — одна из самых востребованных технологий для деминерализации и смягчения природной воды, поскольку позволяет добиться высокой чистоты, соответствующей нормативам промышленных объектов разного назначения. Разнообразие ионитов по составу и конструкционному исполнению позволяет подобрать фильтр как для селективной очистки от определенного иона, так и для комплексного обессоливания водных растворов, исходя из требований производства.
К минусам ионообменной технологии очистки воды можно отнести:
- значительный расход реагентов;
- необходимость восстановления сорбционной способности ионитов;
- большой объем сточных и промывных вод от регенерации;
- стоимость обессоливания воды методом ионного обмена сильно растет с увеличением концентрации солей в водном растворе;
- уменьшение эффективности ионообменного метода опреснения и обессоливания воды с повышением минерализации воды;
- необходимость утилизировать отработанный ионит;
- невысокая скорость фильтрации.
Как выбрать ионообменную установку для воды
Выбирать ионообменные установки для очистки воды нужно, исходя из технических условий на ионообменные материалы, учитывая требования потребителей очищенной воды и экономические показатели. Общие рекомендации при выборе схемы ионообменной очистки воды:
- учитывать температуру очищаемой воды и раствора для регенерации;
- если присутствуют окислители, лучше выбрать макропористый ионит;
- для противоточных установок с большими скоростями рекомендуется применять моносферные иониты с крупными гранулами;
- для предотвращения быстрого загрязнения анионитов органическими веществами обязательна установка предфильтров с поглотителями органики;
- у малокислотных гелевых катионитов ионообменная емкость в равных условиях выше, чем у слабокислотных с макропорами, но они менее прочные.
Мы подберем ионообменные системы для очистки воды
Наша компания предлагает ионообменные колонны для очистки воды для промышленных предприятий разной отраслевой принадлежности. Мы подберем необходимую комплектацию систем для деминерализации воды методом ионного обмена, соответствующей требованиям вашего производственного процесса. Дополнительную информацию можно получить по телефону 8-499-391-39-59, электронной почте [email protected] или оставив заявку в форме обратной связи на нашем сайте.
Ионообменная смола — MEL Chemistry
Реагенты
Безопасность
- Наденьте защитные перчатки и очки.
- Проведите эксперимент на пластиковом лотке.
Общие правила безопасности
- Не допускайте попадания химикатов в глаза или рот.
- Не подпускайте маленьких детей, животных и лиц без защитных очков к экспериментальной зоне.
- Храните этот экспериментальный набор в недоступном для детей младше 12 лет.
- После использования очистите все оборудование.
- Убедитесь, что все контейнеры полностью закрыты и правильно хранятся после использования.
- Убедитесь, что все пустые контейнеры утилизированы надлежащим образом.
- Не используйте оборудование, которое не входит в комплект поставки или не рекомендовано в инструкции по эксплуатации.
- Не заменяйте продукты в оригинальной упаковке. Немедленно утилизируйте.
Общая информация по оказанию первой помощи
- В случае попадания в глаза: промыть глаза большим количеством воды, при необходимости держать глаза открытыми. Немедленно обратитесь за медицинской помощью.
- При проглатывании: прополоскать рот водой, выпить свежей воды.Не вызывает рвоту. Немедленно обратитесь за медицинской помощью.
- В случае вдыхания: вывести человека на свежий воздух.
- В случае контакта с кожей и ожогов: промыть пораженный участок большим количеством воды в течение не менее 10 минут.
- В случае сомнений немедленно обратитесь за медицинской помощью. Возьмите химическое вещество и контейнер с собой.
- В случае травмы всегда обращайтесь к врачу.
Консультации для взрослых
- Неправильное использование химикатов может привести к травмам и ущербу для здоровья. Выполняйте только те эксперименты, которые указаны в инструкции.
- Этот экспериментальный набор предназначен только для детей старше 12 лет.
- Поскольку способности детей очень сильно различаются, даже в пределах возрастных групп, взрослые должны проявлять осмотрительность при выборе экспериментов, подходящих и безопасных для них.Инструкции должны позволять руководителям оценивать любой эксперимент, чтобы установить его пригодность для конкретного ребенка.
- Наблюдающий взрослый должен обсудить предупреждения и информацию о безопасности с ребенком или детьми до начала экспериментов. Особое внимание следует уделять безопасному обращению с кислотами, щелочами и легковоспламеняющимися жидкостями.
- В зоне, окружающей эксперимент, не должно быть никаких препятствий и места для хранения продуктов.Он должен хорошо освещаться и вентилироваться и находиться рядом с водопроводом. Должен быть предусмотрен прочный стол с термостойкой столешницей.
- Вещества в неповторяемой упаковке должны быть израсходованы (полностью) в течение одного эксперимента, то есть после открытия упаковки.
Часто задаваемые вопросы и устранение неисправностей
Я залил смолу в пипетку выше отметки «3» мл.Что я должен делать?
Ничего страшного. Чтобы удалить смолу, зажмите фильтр на отметке «3» мл и вылейте излишек смолы обратно во флакон. Продолжаем эксперимент.
Второй ватный цилиндр немного торчит. Что я должен делать?
Цилиндр не должен выступать сверху. Осторожно вдавите его.Смолу нужно хорошо отжать.
Зачем нужен первый флакон?
Вы будете использовать его для сравнения свойств нефильтрованного и отфильтрованного растворов. Таким образом, вы можете проверить, насколько эффективно работает ваш фильтр!
Могу ли я использовать фильтр после добавления (NH 4 ) 2 CO 3 ?
Да! Мы удалили медь с помощью карбоната аммония, поэтому смолу можно использовать повторно.Вылейте новый раствор медного купороса через фильтр и соберите фильтрат в новый флакон.
Другие эксперименты
Пошаговая инструкция
Приготовьте фильтр из ионообменной смолы.Чтобы повысить эффективность, слегка сожмите смолу с помощью ватных цилиндров и деревянной палочки.
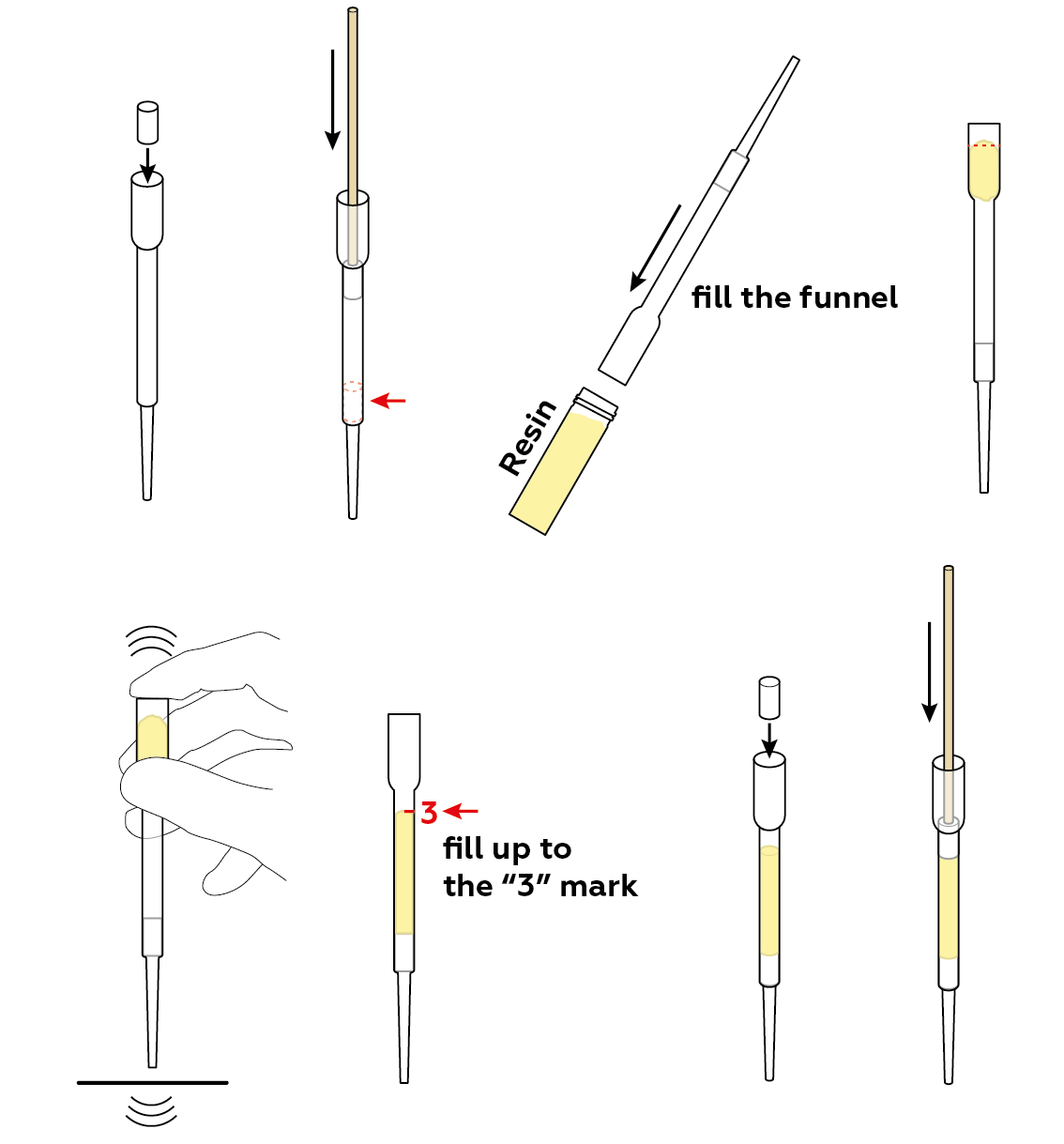
Установите испытательный стенд.
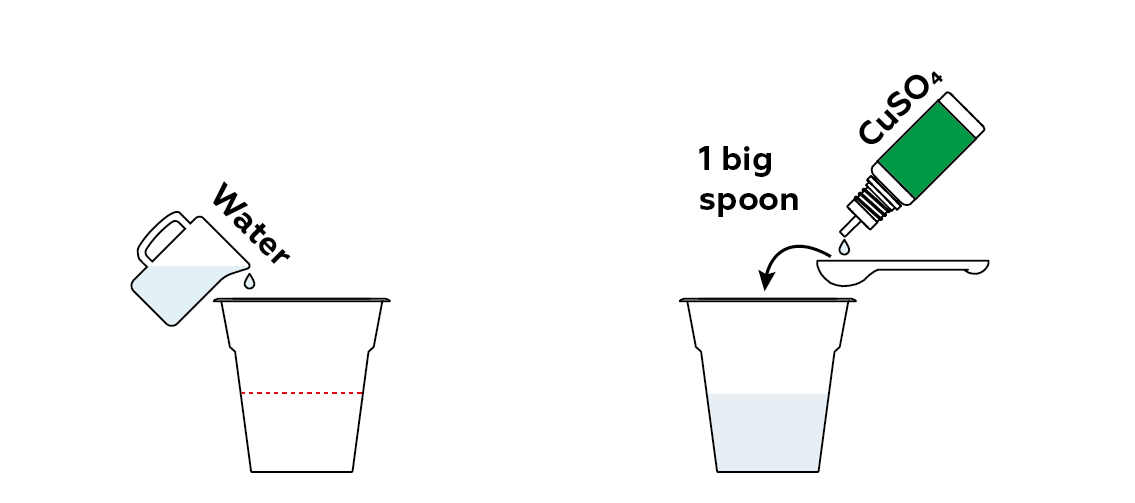
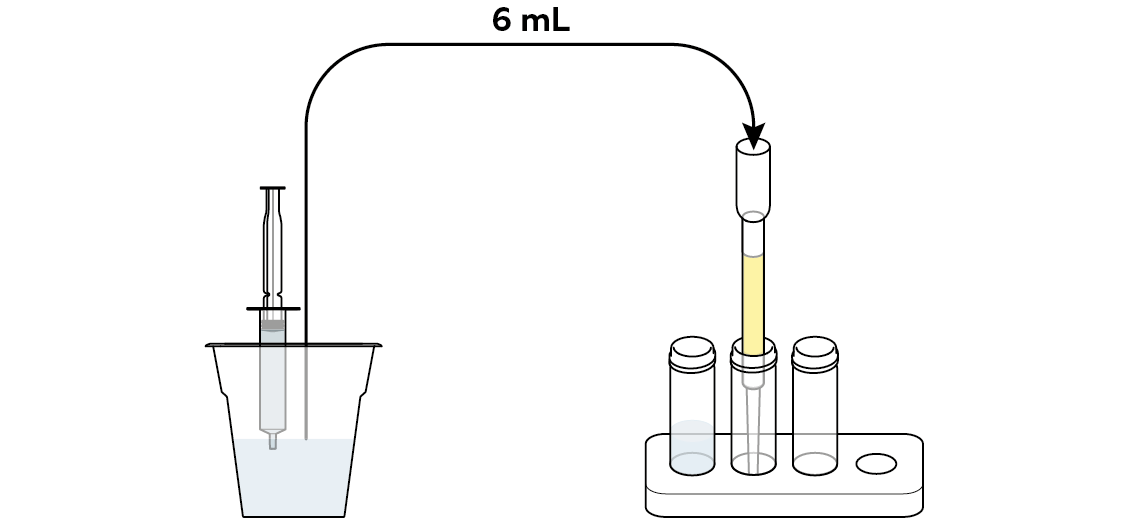
Загрязнить немного воды сульфатом меди CuSO₄. Здесь медь выступает в роли нашего тяжелого металла.
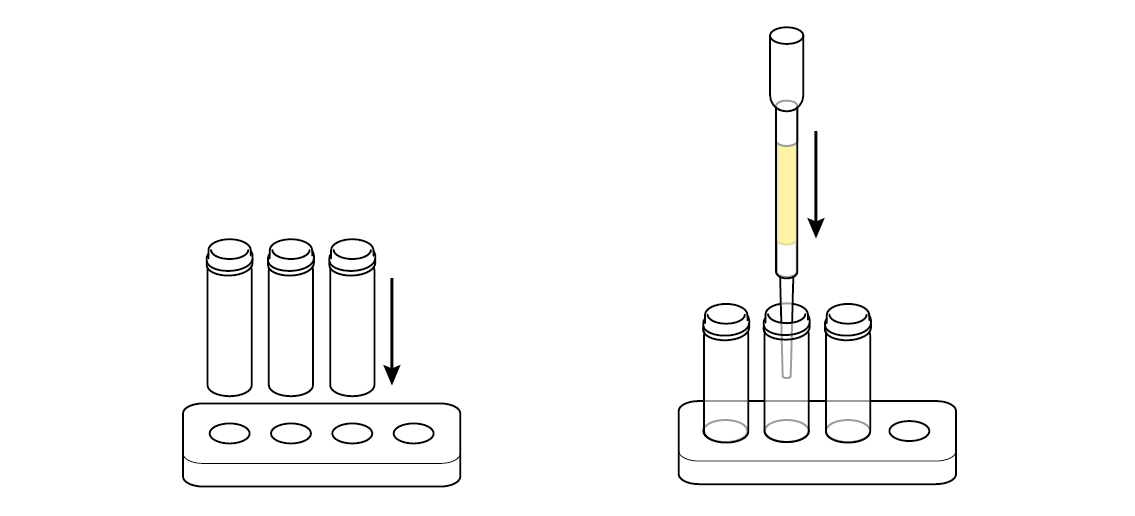
Налейте немного загрязненной воды прямо в первый флакон. Он понадобится вам позже, чтобы оценить эффективность вашего фильтра.
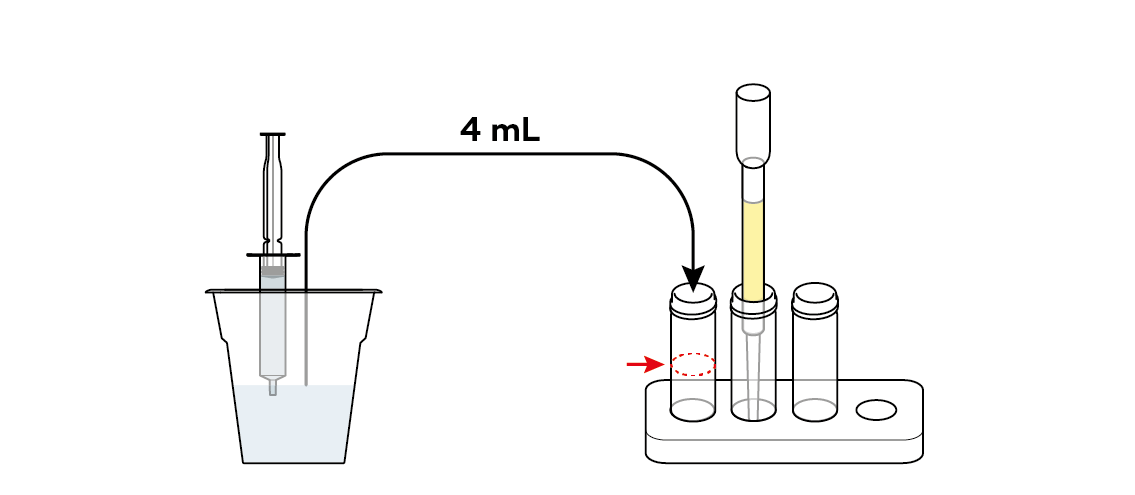
Вылейте немного загрязненной воды через фильтр во второй флакон.
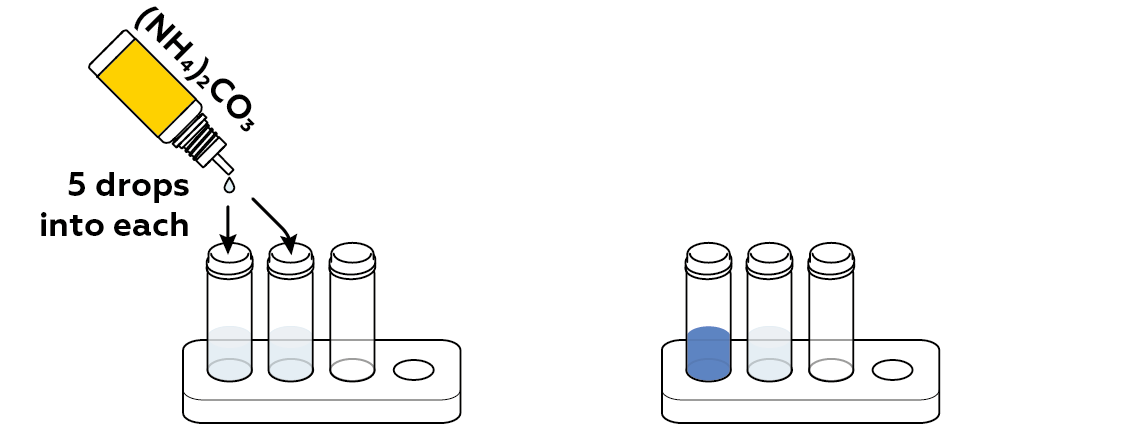
Теперь проведите качественный тест на ионы меди Cu² +, добавив карбонат аммония (NH₄) CO₃ в пробирки. Если раствор содержит ионы меди, жидкость станет синей. Если вашему фильтру удалось очистить воду во втором флаконе, эта вода останется прозрачной.
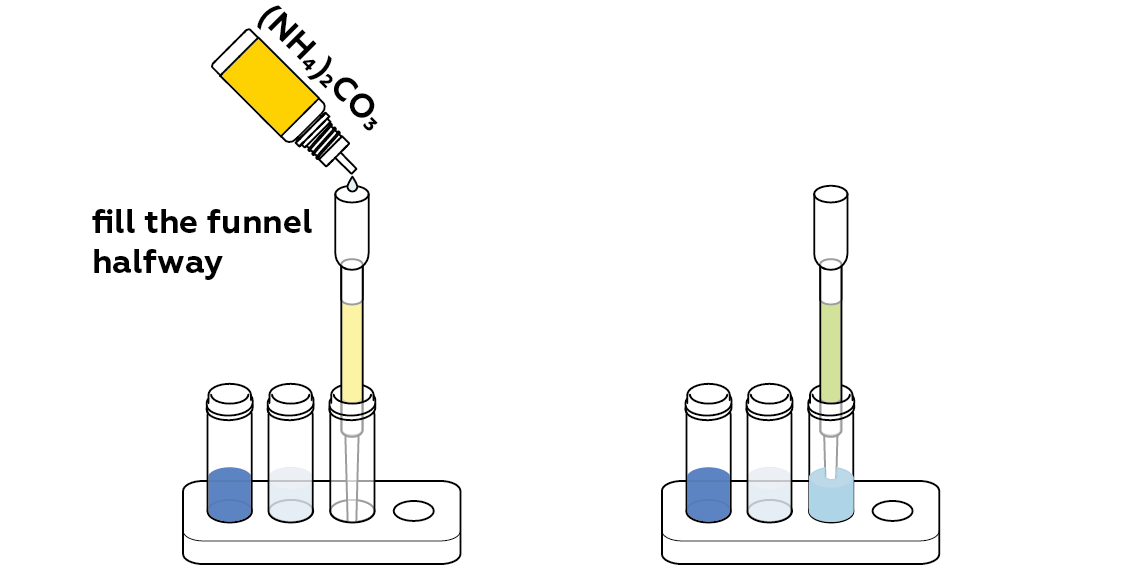
Что произойдет, если нанести на фильтр немного карбоната аммония?
Вымойте оба флакона, чтобы повторить эксперимент.
Ожидаемый результат
Ваш самодельный фильтр с ионообменной смолой очищает воду от ионов тяжелого металла — меди.
Реакция между карбонатом аммония (NH 4 ) 2 CO 3 и ионами меди Cu 2+ изменяет цвет исходного раствора от светло-голубого до темно-индиго. Проба воды, очищенная через фильтр, остается бесцветной, что свидетельствует об эффективности фильтра.
Любые ионы меди, оставшиеся на ионообменной смоле, можно обнаружить, добавив в фильтр несколько капель карбоната аммония.
Выбытие
Утилизировать твердые отходы вместе с бытовым мусором.Слейте растворы в раковину и промойте большим количеством воды.
Научное описание


Вот это интересно!
Почему металлы заменяют друг друга?
Смола работает посредством ионного обмена — обратимого химического процесса, при котором происходит обмен ионов между твердым телом и раствором.В нашем случае отрицательно заряженные ионы жестко прикреплены к матрице зерен смолы. Эти ионы концентрируются на поверхности смолы. Они уравновешиваются положительно заряженными ионами, такими как Na + натрия, которые свободно перемещаются через поры смолы.
В воде сульфат меди CuSO 4 распадается на ионы: положительно заряженный Cu +2 и отрицательно заряженный SO -4 . Когда загрязненный раствор проходит через смолу, поверхность смолы захватывает ионы металла Cu +2 , высвобождая ионы натрия Na + в раствор.Каждая крупинка смолы накапливает эти заряды до определенного предела, после чего ее необходимо очистить от ненужных заряженных частиц. Для этого раствор поваренной соли NaCl пропускается через фильтр для удаления ионов с поверхности смолы. Ионы-вредители смываются в канализацию, а свободное пространство снова заполняется ионами натрия. Это называется регенерацией или переработкой смолы.
Тяжелые металлы в воде
Тяжелые металлы — это семейство химических элементов, наиболее токсичных для человека, особенно если они присутствуют в довольно больших количествах.В воде они обычно существуют в виде положительно заряженных частиц (катионов) — возьмем, например, медь Cu 2+ , свинец Pb 2+ или железо Fe 3+ .
Интересно, что наш организм нуждается в определенных тяжелых металлах в небольших количествах, таких как железо Fe, цинк Zn, медь Cu и молибден Mo. Однако они могут быть вредными, если накапливаются в больших количествах. Между тем, такие тяжелые металлы, как свинец, кадмий и ртуть, даже в небольших количествах вредны для нашего организма.
Многие тяжелые металлы находятся в воде в форме катионов. Их необходимо отфильтровать, чтобы вода стала питьевой. Для этого мы можем использовать фильтр из ионообменной смолы.
.Ионообменная смола | химическое соединение
Ионообменная смола , любое из широкого спектра органических соединений, синтетически полимеризованных и содержащих положительно или отрицательно заряженные участки, которые могут притягивать ион противоположного заряда из окружающего раствора. Смолы обычно состоят из сополимера стирола и дивинилбензола (высокомолекулярное вещество), хотя также используются другие композиции, такие как полимеры метакриловая кислота-дивинилбензол и фенолформальдегид.Электрически заряженные группы обычно представляют собой соли сульфоновой или карбоновой кислоты или соли четвертичного аммония. Полимеры, содержащие кислотные группы, классифицируются как кислотные или катионные обменники, потому что они обмениваются положительно заряженными ионами, такими как ионы водорода и ионы металлов; те, которые содержат группы аммония, считаются основными или анионообменниками, поскольку они обмениваются отрицательно заряженными ионами, обычно гидроксид-ионами или галогенид-ионами.
ионообменная смола Гранулы ионообменной смолы. Адам СмитПодробнее по этой теме
ионообменная реакция: Ионообменные материалы
… в 1935 году, когда первые ионообменные смолы были открыты английскими химиками Бэзилом Альбертом Адамсом и Эриком Лейтон Холмсом.Смолы …
Ионообменные смолы — это легкие и пористые твердые вещества, обычно получаемые в виде гранул, шариков или листов. При погружении в раствор смолы впитывают раствор и набухают; степень набухания зависит от полимерной структуры и общей концентрации ионов в растворе.
Смолы подходящего химического состава и физических свойств могут быть синтезированы по желанию для конкретных применений ионного обмена; таким образом, они составляют основную часть синтетических ионообменных материалов, используемых в лаборатории и промышленности.В промышленных и бытовых применениях ионообменные смолы используются для удаления солей кальция, магния, железа и марганца из воды (умягчение воды), для очистки сахара и для концентрирования ценных элементов, таких как золото, серебро, и уран из минеральных руд. В химическом анализе ионообменные смолы используются для разделения или концентрирования ионных веществ, а в химическом синтезе некоторые ионообменные смолы используются в качестве эффективных катализаторов, особенно в реакциях этерификации и гидролиза.
Два отдельных типа смол обычно классифицируются как ионообменные смолы, хотя их функции не связаны с обменом ионами. Это хелатирующие смолы и электронообменные смолы. Хелатирующие смолы представляют собой полимеры стирол-дивинилбензол, в которые введены иминодиацетатные группы. Эта функциональная группа образует комплексы со всеми металлическими элементами, за исключением щелочных металлов, со стабильностью, которая варьируется в зависимости от различных металлов; в аналитической химии они используются для отделения следов металлов.Электронообменные смолы принимают или отдают электроны окружающему раствору и используются в окислительно-восстановительных реакциях; примеры включают полимеры, полученные из гидрохинона, фенола и формальдегида.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчасГруппа минералов, обладающих ионообменными свойствами, представляет собой цеолиты ( q.v. ).
.Влияние чрезвычайно высокой удельной скорости потока на сорбционные характеристики ионообменной смолы
Следующие результаты представляют данные, полученные при определении оптимальной удельной скорости потока, сорбционных характеристик и кинетики сильноосновной ионообменной смолы.
3.1. Результаты, полученные при определении оптимального удельного расхода сильноосновной ионообменной смолы
При изменении SFR и EBCT были получены значимые данные измеренных параметров.Зависимости измеренных параметров и значений расхода в экспериментах с нехлорированной и хлорированной водой показаны на рисунках 4-7. На рисунке 4 представлена зависимость значения pH и содержания бикарбоната в сточных водах и значений SFR (A), а также влияние SFR на электропроводность и концентрации хлоридов (B) как в нехлорированной, так и в хлорированной воде.
Рис. 4.
Влияние SFR на содержание бикарбонатов и pH (A), а также электропроводность и содержание хлоридов (B)
При первоначальном сорбционном контакте грунтовых вод со смолой происходило резкое снижение pH сточных вод. принято к сведению.Это наблюдение особенно ярко проявилось в случае хлорированной воды. Высокое сродство смолы к ионам бикарбоната в начальной фазе ионного обмена приводит к увеличению кислотности стоков. Минимумы pH и концентрации бикарбоната наблюдались при более низких значениях SFR по сравнению с теми, которые были измерены в нехлорированной воде. Эти результаты являются следствием присутствия образующегося кислорода в хлорированной воде, который ускоряет ионный обмен хлорида на бикарбонат на смоле.Первоначальный интенсивный обмен этими ионами постепенно уравновешивается адсорбцией анионов гуминовых кислот, имеющей место до SFR 50 BV / h, поскольку места, в которых динамическое равновесие сорбции и десорбции бикарбоната смещается внутрь гранулы смолы, а гуминовая кислота связывается с функциональными группами на их внешней поверхности. В конце исследованного диапазона SFR концентрация HCO 3 — в сточных водах оставалась практически постоянной и асимптотически достигала концентрации в подземных водах.При более высоком SFR значение pH сточных вод приближается к значению pH сырой воды вследствие изменения концентрации бикарбоната. После значения SFR 50 BV / ч смола находится в хлоридной форме. На рисунке 4 (A) также показано, что в начальной части рабочего цикла смолы с хлорированной водой, уже при SFR 2-6 BV / ч наблюдается немедленное уменьшение содержания бикарбонатов в сточных водах, после чего содержание бикарбонатов медленно увеличивается. до SFR 50 BV / h, где бикарбонаты до самого конца рабочего цикла достигают концентрации, аналогичной концентрации в сырой воде.Огромное увеличение концентрации хлоридов при малых SFR происходит одновременно с заметным снижением содержания бикарбоната в сточных водах, рис. 4 (B). Это повышение концентрации хлорида, однозарядная малая и высокая скорость диффузии приводит к увеличению измеренной проводимости. Более высокий рост концентрации хлоридов наблюдался в случае хлорированной воды, что понятно, если принять во внимание выделение хлорида из хлорной кислоты.Различия в пиках концентрации хлоридов и электропроводности в сточных водах для хлорированной и нехлорированной воды, безусловно, являются следствием образования образующегося кислорода, который также активирует функциональные группы смолы и, таким образом, способствует более эффективному ионному обмену.
Рис. 5.
Изменения концентрации сульфата и мышьяка (A), а также концентрации NOM (B) в стоках с SFR
Влияние образующегося кислорода на окисление As (III) в As (V) Это очевидно из того факта, что в широком диапазоне SFR, от 2 до 300 BV / ч, общая концентрация мышьяка в стоках хлорированной воды постоянно была ниже значения MTC [47] (Рисунок 5 (A)).С другой стороны, в случае нехлорированной воды концентрации мышьяка в сточных водах при SFR <100 BV / ч были в 10 раз, а при 100
Рисунок 6.
Влияние EBCT на удаление NOM (A) и мышьяка (B)
3.2.Результаты, полученные при определении сорбционных характеристик сильноосновной ионообменной смолы
В ходе исследования оптимального удельного расхода сильноосновной ионообменной смолы был сделан вывод, что оптимальный расход амберлайта IRA-958 составлял 40 л / ч, т.е. SFR 30 BV / ч ± 5% при использовании на описанных грунтовых водах. Данное исследование было проведено с целью определения сорбционных характеристик смолы на основе экспериментальных данных и данных производителя [11].Согласно данным производителя, один грамм смолы может адсорбировать от 3,47 до 5,21 мгО 2 НОМ, выраженное как ХПК. Исследованные подземные воды содержат 7,73 мгО 2 / л НОМ, выраженное как ХПК. Расчет показывает, что один грамм SBIX может адсорбировать НОМ от 0,45 до 0,67 л такой воды. Принимая во внимание массу смолы 970 г, можно рассчитать, что общий объем грунтовых вод от 436,5 л до 650 л может быть эффективно обработан с помощью использованного SBIX.Если это выражается через значения BV, ожидаемая адсорбционная способность смолы по NOM находится в диапазоне от 312 BV до 464 BV.
Рис. 7.
Изменения содержания NOM (A) и мышьяка (B) в сточных водах в зависимости от общего объема сырой воды, прошедшей через SBIX
В начальной части процесса сорбции при малых объемах сырой воды около 2 900 BV, а также при больших объемах более 13 500 BV, удаление NOM из хлорированной воды более эффективно.В первой части рабочего цикла образующийся кислород, генерируемый хлорной кислотой, вызывает разложение NOM и более эффективную сорбцию продуктов разложения HAs и FA по сравнению с природными гуминами, присутствующими в нехлорированной воде. Эти процессы происходят в среде ионной конкуренции, как описано авторами [40]. При увеличенных объемах грунтовых вод, проходящих через систему, поверхностная адсорбция является доминирующим процессом, в результате которого органическое вещество накапливается на внешней поверхности жемчужин из смолы.В этом процессе природные ГК из нехлорированной воды более эффективно связываются с функциональными группами смолы, чем более мелкие молекулы, образующиеся в результате разложения гумина под действием образующегося кислорода. Из-за большего количества вновь образованных молекул в выходящем потоке хлорированной воды при меньшем общем объеме воды, проходящей через систему, предел насыщения смолы и ХПК в 2 мгO 2 / л [47] достигается быстрее, около 3000 BV. В то же время адсорбция более крупных молекул на смоле, которая контактировала с нехлорированной водой, происходит медленнее, и предел ХПК появляется на уровне 4000 BV.Из анализа значений TOC сточных вод из хлорированной воды следует, что изменения этого параметра с объемом очищенной воды аналогичны изменениям, наблюдаемым для ХПК. Однако изменения TOC в стоках нехлорированной воды показывают, что до значения примерно 8000 BV удаление NOM, выраженное через TOC, более эффективно, чем при выражении через COD, и после этого эти значения становятся пропорционально эквивалентными. Это различие можно объяснить тем, что в отсутствие окислителя в воде определение ХПК перманганатным методом дает более низкие результаты.А именно, перманганат не является достаточно сильным окислителем, чтобы полностью окислить гуминовое вещество, а является только его более легко окисляемой частью — фульвокислотами. С другой стороны, метод TOC охватывает все растворенные NOM, и это является причиной расхождения между результатами COD и TOC, представленными на рисунке 7 (A). В начальной фазе насыщения смолы молекулы NOM, которые легче окисляются (то есть C L ), предпочтительно адсорбируются на смоле. С увеличением количества адсорбированного NOM, пропорционального объему обработанной воды выше 8000 BV, сродство смолы к сорбции органического вещества становится ниже, и большие количества легко окисляемого NOM остаются в сточных водах, так что изменения в COD и TOC пропорциональны, что видно из рисунка 7 (A).А именно, внешний вид кривых ХПК и ТОС выше 8000 BV становится идентичным, поскольку значение ХПК, например, 3 и 6 мгО 2 / л пропорционально значениям ТОС 4 и 8 мг / л. Как видно из рисунка 7 (B), концентрации мышьяка в стоках из хлорированной воды ниже MTC 0,01 мг / л только до примерно 700 BV. Наблюдая за воздействием дальнейшего потока грунтовых вод, можно увидеть, что удаление мышьяка примерно одинаково эффективно до примерно 5000 BV как из хлорированной, так и из нехлорированной воды.При значениях BV выше примерно 7000 влияние образующегося кислорода на удаление мышьяка представляет собой сложный процесс. В исследованных подземных водах сложного состава может протекать ряд окислительно-восстановительных реакций параллельно. Реакции деградации ГК преобладают над реакциями окисления As (III). При увеличении объема обработанной воды, превышающем 5000 BV, количество удаленного мышьяка было вдвое больше, когда обработанная вода содержала гипохлорит. В присутствии окислителя процессы сорбции НОМ, конкурирующие со связыванием арсената с SBIX, более выражены.Повышенные концентрации мышьяка в стоках из хлорированной воды появляются как следствие десорбции мышьяка. Процесс десорбции был особенно выражен при объемах, превышающих 14 000 BV, и происходил одновременно с тенденцией к снижению концентрации мышьяка в стоках из нехлорированной воды.
Выражения (6) — (21) использовались для расчета концентраций NOM и мышьяка в общем объеме подземных вод в экспериментах с хлорированной и нехлорированной водой, количества NOM и мышьяка в сточных водах во время эксперимента, так как а также количества NOM и мышьяка, адсорбированных на SBIX.Общие количества NOM и As, прошедших через смолу, а также количества, которые загружают смолу, представлены в таблице 3.
| Сорбционные характеристики | CODtotal (gO2) | CODload (gO2 / g) | TOCtotal (g) | TOCload (g / g) | Astotal (g) | Asload (g / g) | BV |
| Без хлора | 175.65 | 0,181 | 241,86 | 0,249 | 6,039 | 0,006 | 16,231 |
| Присутствие хлора | 179,90 | 0,185 | 166 247,710,255 | 6,186 | 0 Таблица 3. |
