Флуоресцентные лампы, их особенности и применение
Среди энергосберегающих источников света первыми на рынке появились флуоресцентные лампы. Без них представить современные офисы, складские помещения, крупные магазины, а также школы и больницы просто невозможно. Такие лампы дневного света значительно экономят электроэнергию, характеризуются теплым белым излучением, высоким ресурсом и демократичными ценами, что и способствует их широкому распространению.
 Им присущ достаточно длительный срок эксплуатации — до 20 тыс. часов, но при условии минимального количества циклов включения и выключения (при других условиях они выходят из строя гораздо быстрее).
Им присущ достаточно длительный срок эксплуатации — до 20 тыс. часов, но при условии минимального количества циклов включения и выключения (при других условиях они выходят из строя гораздо быстрее).На сегодняшний день современному покупателю предлагаются флуоресцентные лампы с высокой интенсивностью. Они содержат химические компоненты, которые помогают сглаживать скачки светового спектра. Правда, они не способны проектировать свет на большое расстояние, поэтому применяются для обеспечения видимости близкорасположенных предметов.
Стоит отметить, что флуоресцентные лампы чаще всего выпускаются в виде стеклянных трубок, которые наполнены специальным металлическим порошком и содержат на своих концах электроды. Они характеризуются сбалансированным цветом, что позволяет получать мягкий свет, лишенный тени. Выпускаются мощностью 18-36 Вт и длиной 60-120 см, световой температурой до 6400 К, поэтому каждый может подобрать для себя наиболее подходящую модель.
 Кроме того, компактные флуоресцентные лампы выпускаются разных форм — обычной колбы, небольшой спирали или в виде лотоса. На рынке также представлены их рефлекторные виды, которые имеют специальное алюминиевое покрытие. Оно дает более направленный световой поток, что важно для обеспечения соответствующего дизайна помещений.
Кроме того, компактные флуоресцентные лампы выпускаются разных форм — обычной колбы, небольшой спирали или в виде лотоса. На рынке также представлены их рефлекторные виды, которые имеют специальное алюминиевое покрытие. Оно дает более направленный световой поток, что важно для обеспечения соответствующего дизайна помещений.Надо сказать, что лампы флуоресцентные незаменимы в случаях, когда требуется осветить промышленное или деловое помещение, поскольку они имеют высокую отдачу и дают равномерный свет. Им свойственны компактные размеры и красивый вид. Кроме того, они не требуют профессионального подключения, так как легко могут использоваться вместо традиционных ламп накаливания и без проблем устанавливаться в стандартный цоколь. При этом технический свет можно получить не только с помощью светильников строгих форм, но и моделей, которые выполнены по последним тенденциям дизайнерского искусства.
 Если говорить о газоразрядных флуоресцентных лампах, то они напоминают неоновые вывески и являются стеклянными колбами, в которых применяются пары ртути и натрия. Внутренняя поверхность таких ламп покрыта специальным составом, который называется люминофором и превращает ультрафиолетовые лучи в видимый спектр света.
Если говорить о газоразрядных флуоресцентных лампах, то они напоминают неоновые вывески и являются стеклянными колбами, в которых применяются пары ртути и натрия. Внутренняя поверхность таких ламп покрыта специальным составом, который называется люминофором и превращает ультрафиолетовые лучи в видимый спектр света.Надо сказать, что при добавлении к ртутно-газовой смеси этих ламп отдельных примесей можно получить свечение различного спектра — белого, цветного или черного (УФ). Если же для их изготовления применить специальное кварцевое стекло, то можно получить лампы, которые используют в медицине, поскольку характеризуются УФ излучением ртути и дают бактерицидный эффект.
Флуоресцентная лампа — Википедия
Материал из Википедии — свободной энциклопедии
(перенаправлено с «»)Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 августа 2017; проверки требуют 14 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 августа 2017; проверки требуют 14 правок.
 Различные виды люминесцентных ламп
Различные виды люминесцентных лампЛюминесце́нтная ла́мпа — газоразрядный источник света, в котором электрический разряд в парах ртути создаёт ультрафиолетовое излучение, которое преобразуется в видимый свет с помощью люминофора — например, смеси галофосфата кальция с другими элементами.
Световая отдача люминесцентной лампы в несколько раз больше, чем у ламп накаливания аналогичной мощности. Срок службы люминесцентных ламп около 5 лет при условии ограничения числа включений до 2000, то есть не больше 5 включений в день в течение гарантийного срока 2 года.
Разновидности[ | ]
Наиболее распространены газоразрядные ртутные лампы высокого и низкого давления.
- лампы высокого давления применяют в основном в уличном освещении и в осветительных установках большой мощности;
- лампы низкого давления применяют для освещения жилых и производственных помещений.
Газоразрядная ртутная лампа низкого давления (ГРЛНД) представляет собой стеклянную трубку с нанесённым на внутреннюю поверхность слоем люминофора, заполненную аргоном под давлением 400 Па и ртутью (или амальгамой).
Плазменные дисплеи также являются разновидностью люминесцентной лампы.
Область применения[ | ]
 Коридор, освещённый люминесцентными лампами
Коридор, освещённый люминесцентными лампамиЛюминесцентные лампы нашли широкое применение в освещении общественных зданий: школ, больниц, офисов и т. д. С появлением компактных люминесцентных ламп с электронными балластами, которые можно включать в патроны E27 и E14 вместо
Флуоресценция — Википедия


Флуоресце́нция, или флюоресценция — физический процесс, разновидность люминесценции. Флуоресценцией обычно называют излучательный переход возбуждённого состояния с самого нижнего синглетного колебательного уровня S1 в основное состояние S0[источник не указан 587 дней
Флуоресценцию следует отличать от фосфоресценции — запрещённого по спину излучательного перехода между двумя состояниями разной мультиплетности. Например, излучательный переход возбуждённого триплетного состояния T1 в основное состояние S0. Синглет-триплетные переходы имеют квантовомеханический запрет, поэтому время жизни возбуждённого состояния при фосфоресценции составляет порядка 10−3−10−2 с[2].
Термин «флуоресценция» происходит от названия минерала флюорит, у которого она впервые была обнаружена, и лат. -escent — суффикс, означающий слабое действие.
Впервые флуоресценцию соединений хинина наблюдал физик Джордж Стокс в 1852 году.
Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями и частота колебаний поглощённого света соотносятся между собой уравнением (II постулат Бора):
- E2−E1=hν.{\displaystyle E_{2}-E_{1}=h\nu .}
После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии[3].
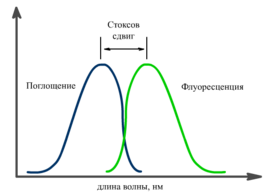
Соотношение спектров поглощения и флуоресценции[править | править код]
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название «Стоксов сдвиг». Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощённого фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны
Схематическое изображение процессов испускания и поглощения света. Диаграмма Яблонского[править | править код]
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.
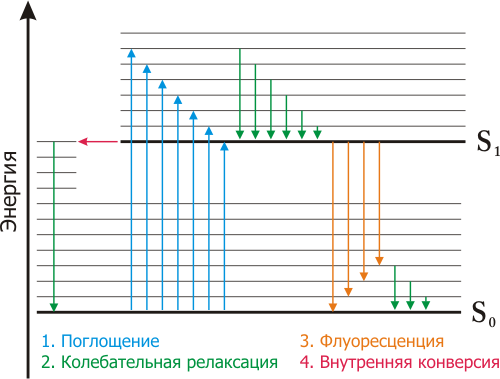
При нормальных условиях большинство молекул находятся в основном электронном состоянии S0{\displaystyle S_{0}}. При поглощении света молекула переходит в возбуждённое состояние S1{\displaystyle S_{1}}. При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный подуровень состояния S1{\displaystyle S_{1}}. Однако, существуют и исключения: например, флуоресценция азулена может происходить как из S1{\displaystyle S_{1}}, так и из S2{\displaystyle S_{2}} состояния.
Квантовый выход флуоресценции[править | править код]
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле
- Φ=NemNabs{\displaystyle \Phi ={\frac {N_{em}}{N_{abs}}}}
где Nem{\displaystyle {N_{em}}} — количество испускаемых в результате флуоресценции фотонов, а Nabs{\displaystyle {N_{abs}}} — общее количество поглощаемых фотонов. Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощённой диаграммы Яблонского[6], где Γ{\displaystyle {\Gamma }} и knr{\displaystyle k_{nr}} — константы скорости излучательной и безызлучательной дезактивации возбуждённого состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:
- Φ=ΓΓ+knr{\displaystyle \Phi ={\frac {\Gamma }{\Gamma +k_{nr}}}}
Из последней формулы следует, что Φ→1{\displaystyle \Phi \rightarrow 1} если knrΓ→0{\displaystyle {\frac {k_{nr}}{\Gamma }}\rightarrow 0}, то есть если скорость безызлучательного перехода значительно меньше скорости излучательного перехода. Отметим, что квантовый выход всегда меньше единицы из-за стоксовых потерь.
Флюоресценция в ультрафиолетовом свете 0,0001 % водных растворов: голубым — хинина, зелёным — флуоресцеина, оранжевым — родамина-B, жёлтым — родамина-6GК флуоресценции способны многие органические вещества, как правило содержащие систему сопряжённых π-связей. Наиболее известными являются хинин, метиловый зелёный, метиловый синий, феноловый красный, кристаллический фиолетовый, бриллиантовый синий кризоловый, POPOP, флуоресцеин, эозин, акридиновые красители (акридиновый оранжевый, акридиновый жёлтый), родамины (родамин 6G, родамин B), нильский красный и многие другие.
В производстве красок и окраске текстиля[править | править код]
Флуоресцентные пигменты добавляются в краски, фломастеры, а также при окраске текстильных изделий, предметов обихода, украшений и т. п. для получения особо ярких («кричащих», «кислотных») цветов с повышенным спектральным альбедо в нужном диапазоне длин волн, иногда превышающим 100 %. Данный эффект достигается за счёт того, что флуоресцентные пигменты преобразуют содержащийся в естественном свете и в свете многих искусственных источников ультрафиолет (а также для жёлтых и красных пигментов, коротковолновую часть видимого спектра) в излучение нужного диапазона, делая цвет более интенсивным. Особой разновидностью флуоресцентных текстильных пигментов является оптическая синька, преобразующая ультрафиолет в излучение синего цвета, компенсирующее естественный желтоватый оттенок ткани, чем достигается эффект белоснежного цвета одежды и постельного белья. Оптическая синька применяется как при фабричной окраске тканей, так и для освежения цвета при стирке, в стиральных порошках. Аналогичные пигменты применяются и в производстве многих сортов бумаги, включая бумагу для повседневного офисного использования. В ней содержание пигмента с синькой, как правило, наибольшее.
Флуоресцентные краски, в сочетании с «чёрным светом», часто используются в дизайне дискотек и ночных клубов. Практикуется также применение флуоресцентных пигментов в красках для татуировки.
В технике[править | править код]
В технические жидкости, например — антифризы, часто добавляют флюоресцентные добавки, облегчающие поиск течи из агрегата. В ультрафиолетовом свете подтёки такой жидкости становятся очень хорошо заметны.
В биологии и медицине[править | править код]
 Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла В биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются для визуализации отдельных компонентов биологических систем. Например, эозинофилы (клетки крови) называются так потому, что имеют сродство к эозину, благодаря чему легко поддаются подсчёту при анализе крови.
Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла В биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются для визуализации отдельных компонентов биологических систем. Например, эозинофилы (клетки крови) называются так потому, что имеют сродство к эозину, благодаря чему легко поддаются подсчёту при анализе крови.Лазеры[править | править код]
Флуорофоры с высокими квантовыми выходами и хорошей фотостойкостью могут применяться в качестве компонентов активных сред лазеров на красителях.
В криминалистике[править | править код]
Отдельные флуоресцирующие вещества используются в оперативно-разыскной деятельности (для нанесения пометок на деньги, иные предметы в ходе документирования фактов дачи взяток и вымогательства. Также могут использоваться в химловушках)
В гидрологии и экологии[править | править код]
Флуоресцеин был применен в 1877 для доказательства того, что реки Дунай и Рейн соединены подземными каналами.[7]. Краситель внесли в воды Дуная и спустя несколько часов характерную зелёную флуоресценцию обнаружили в небольшой речке, впадающей в Рейн. Сегодня флуоресцеин используют также как специфический маркёр, который облегчает поиск потерпевших крушение лётчиков в океане. Для этого просто разбивается ампула с красителем, который, растворяясь в воде, образует хорошо заметное зелёное пятно большого размера. Также флуорофоры могут использоваться для анализа загрязнения окружающей среды (обнаружение утечки нефти (масляных плёнок) в морях и океанах).
- Лабас Ю. А., Гордеева А. В., Фрадков А. Ф. Флуоресцирующие и цветные белки // Природа, 2003, № 3.
- Векшин Н. Л. Флуоресцентная спектроскопия биополимеров. Пущино, Фотон-век, 2009.
- Флюоресценция // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Флуоресценция — статья из Большой советской энциклопедии.
- Лозовская Е. Почему они светятся // Наука и жизнь, 2004, № 8.
- Свечение минералов // Наука и жизнь, 1998, № 5
Ответы@Mail.Ru: Объясните доступные языком — Что такое флуоресцентные лампы?
Лампы, в которых внутренняя стенка покрыта специальным порошком — люминофором. Он и светится. Это как раз белые лампы-трубки, которые в офисах стоят.
Светится не газ а покрытие внутри лампы
Проще простого это лампы дневного цвета, т. е. неоновые
Газоразрядные = ртутные = лампы дневного света
Флуоресцентная (точнее, люминесцентная) лампа — лампа, в которой основным источником света является разряд в ионизированном газе или парах металла (например, ртути, натрия) , а дополнительным — люминесценция нанесённого на внутренние стенки лампы люминофора.
Они потребляют примерно в 5 раз меньше мощности…. в них газ.. . от 5 до 15 раз служат дольше чем лампы накаливания …дорогие нельзя регулировать свет.. энергосберегающие
Доступным языком — это лампы дневного сета (сейчас ещё называют ЭКОНОМ) и, как сказала Лариска в них действительно пары ртути или газ!!!
Разновидность люминисцентных ламп <a rel=»nofollow» href=»/» title=»4305604:##:http://www.terraria.ru/lamp10″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a> и <a rel=»nofollow» href=»http://www.grandelectro.ru/catalog/orbitec/neon_lamp» target=»_blank»>http://www.grandelectro.ru/catalog/orbitec/neon_lamp</a>
Флуоресцентные лампы — лампы чёрного света
Автор Фома Бахтин На чтение 2 мин. Просмотров 845 Опубликовано
Общая информационная статья описывающая устройство и свойства флуоресцентных ламп
Другое название флуоресцентных ламп – лампы чёрного света. Способность создавать различные зрительные эффекты, благодаря длинноволновому видимому излучению позволяет с большим успехом использовать их, чаще всего, для реализации декоративного освещения, воплощения различных дизайнерских решений. Светильники с этими трубчатыми лампами, чаще всего можно увидеть в супермаркетах, аэропортах, различных развлекательных центрах, заведениях. Кроме того, они могут использоваться и в театрах – для освещения сцен.
Устройство и работа флуоресцентных ламп. Стеклянная трубка этих газоразрядных ламп низкого давления заполнена парами ртути с небольшой примесью аргона. На обоих концах трубки находятся металлические электроды, имеющие специальную оболочку, легко отдающую электроны при пропускании электрического тока.
Некоторые флуоресцентные светильники при включении некоторое время мигают. Это происходит из-за того, что парам ртути требуется некоторое время для того, чтобы зарядиться, или, что, то же самое – ионизироваться. Ионизация достигается созданием на электродах напряжения, в четыре раза превышающее рабочее, с помощью пускорегулирующей аппаратуры – ПРА (дроссель+стартер).
При этом происходит массовый выброс электронов, которые заряжают ртуть. Как только пары ртути в трубке становятся полностью ионизированными, стартер автоматически выключается, и лампа начинает работать в обычном режиме. Иногда стартер должен сработать два или три раза, чтобы зарядить ртуть, хотя аргон, который в небольшом количестве присутствует в трубке, ускоряет процесс.

Когда пары ртути ионизированы, электроны начинают сталкиваться с ионизированными атомами ртути. В результате этих столкновений происходит излучение ультрафиолетового света. Если бы светильники изготовлялись из обычного стекла, то мы вообще не могли бы пользоваться ими, поскольку ультрафиолет не воспринимается человеческим глазом. Именно для преобразования света в видимый, внутреннюю поверхность светильника покрывают либо силикатом цинка, либо вольфраматом магния. Эти вещества ведут себя необыкновенно, когда на них попадает ультрафиолетовый свет. Они начинают флуоресцировать, т. е. светиться видимым светом, поскольку преобразуют ультрафиолет в белый свет. Именно внутреннее покрытие трубки придает ровный оттенок излучаемому свету.
Особенности флуоресцентных ламп. Помимо особенного света излучения, нельзя не упомянуть и другие особенности флуоресцентных ламп: довольно, большой рабочий ресурс – более 20000 часов; экономичность энергопотребления; практически, не нагреваются в работе.
Самодельная лампа Чёрного света (лампа Вуда)
Запуск старых ламп дневного света с потерянной эмиссией, Fluorescent Lamp
Разница между флуоресцентной и люминесцентной краской: что и когда светится
02 Января 2019При выборе краски вы уже наверняка знаете, в каких условиях она должна светиться. Основное отличие между флуоресцентной и люминесцентной краской заключается именно в этом. Чтобы состав светился, на некоторые краски нужно светить ультрафиолетом, а некоторые – «заряжать» светом заранее.
В чем разница между флуоресцентным и люминесцентным свечением?
Различия в типе и продолжительности свечения, а также в области применения краски задает пигмент:
- люминофор;
- флуоресцентный;
- комбинированный.
В комбинированных (смешанных) составах можно использовать особенности обоих базовых видов красок и получать не только «двойное» свечение, но и повышенную яркость цветов.
Краска с люминофором
Это яркая светящаяся краска, которая проявляет свои свойства в темноте. Длительность свечения может составлять от нескольких секунд до суток.
Основные особенности:
- второе название – фосфоресцентная или фосфорная краска;
- очень маленький размер пигментных частиц – 5 микрон;
- время заряда для работы 1/3-1/2 суток – 13-30 минут;
- естественный оттенок свечения – зеленовато-голубой;
- красящий состав служит долго – от 30 лет.
Сразу после «зарядки» пигмент выдает максимальную интенсивность свечения, которая начинает постепенно снижаться.
Экологически чистый и безопасный состав с люминофором часто используется как краска для тела и лица, декоративное покрытие игрушек и детских комнат. Из-за высокой устойчивости к яркому солнечному свету, эти составы часто используют для обработки объектов на открытом воздухе.
Краска с флуоресцентным эффектом
Этой краске для проявления свечения нужно облучение ультрафиолетом. Принцип действия таких составов – поглощение невидимого глазу УФ-излучения и преобразование его в цвета видимого спектра. Купив ультрафиолетовую лампу, можно легко обнаружить привычные объекты, которые будут светиться в темноте – мыло, бумага, коричневые пятна на шкурках бананов и т.д.
Основные особенности:
- обычно дешевле люминесцентных;
- свечение ярче, чем у люминесцентных;
- базовых цветов – 8, остальные оттенки смешиваются;
- размер пигментных частиц – 75 микрон;
- нельзя использовать под ярким солнцем и температуре выше 150˚.
Флуоресцентная краска бывает:
- Видимой. Состав изначально обладает определенным цветом, который становится ярче и светится под ультрафиолетовыми лучами.
- Невидимой. Невидимая краска, светящаяся в ультрафиолете, при дневном свете не видна на базовом покрытии, но под УФ проявляет свои свойства.
Из-за доступности по цене, такие краски часто используются для интерьерной отделки.
Применение
Светящуюся краску можно использовать практически где угодно. Пигменты можно смешивать с разными составами – от лака для ногтей до эпоксидной смолы. В готовом виде чаще всего можно найти краску в баллончиках, аквагрим, акриловые краски, наборы для боди-арта.
Tricolor.com.ua предлагает большой выбор недорогих качественных пигментов и готовых светящихся красок для любых целей – от свободного творчества и мейкапа до покраски машин и зданий!
Люминофор — Википедия
Люминофо́р (от лат. lumen — свет и др.-греч. φορός — несущий) — вещество, способное преобразовывать поглощаемую им энергию в световое излучение (люминесцировать).

 Часы с тритиевым люминофором
Часы с тритиевым люминофоромПо химической природе люминофоры разделяются на неорганические (фосфо́ры), большинство из которых относится к кристаллофосфо́рам, и органические (органолюминофоры). Свечение неорганических люминофоров (кристаллофосфоров) обусловлено в большинстве случаев присутствием посторонних катионов, содержащихся в малых количествах (от 0,0001 % до 2 %).
Такие примеси (активаторы) обычно являются ионами переходных металлов, например, люминесценция сульфида цинка активируется примесью ионов меди.
Люминесценция — нетепловое свечение вещества, происходящее после поглощения им энергии возбуждения. Впервые люминесценция была описана в XVIII веке.
Один из видов люминесценции, хемилюминесценция (свечение в результате химической реакции), наблюдался впервые в 1669 году Хеннигом Брандом, открывшим фосфор.[1]
До ХХ века теоретические представления о сущности хемилюминесценции, сходились на том, что часть выделяющейся при химической реакции энергии не превращается в теплоту; атомы реагирующих веществ переходят при этом в возбужденное состояние, проявляющееся в свечении.
В ХХ веке Каутский и Цохер в работе над ненасыщенными соединениями кремния обнаружили, что при действии света на них происходит очень яркое явление хеми-, катодо- и фотолюминесценции (фосфоресценции и флюоресценции). Ученые обнаружили, что при охлаждении происходит усиление люминесценции, что навело их на мысль о том, что источником хемилюминесценции могут быть те же объекты, которые вызывают флюоресценцию, то есть атомы вещества, которые не принимают непосредственного участия в химической реакции, а получающие энергию для свечения от прореагировавших частиц.
В 20-х годах ХХ века по инициативе С. И. Вавилова начались исследования, направленные на создание люминесцентных ламп, новых для того времени источников света. В то же время О. В. Лосевым была обнаружена электролюминесценция, впоследствии, использующаяся в производстве светодиодов.
С начала 90-х годов помимо традиционных явлений люминесценции (газового разряда, фотолюминесценции, инжекционной и полевой электролюминесценции, низко- и высоковольтовой катодолюминесценции) началось исследование катодолюминесценции в среднем диапазоне энергий электронного пучка.[2]
В настоящее время явление люминесценции активно используется в создании люминесцентных ламп и светодиодов, в люминофорных экранах для медицинского оборудования, в цветных экранах телевизоров и других электронных приборов, в дизайне, а также в системе безопасности и эвакуации.
С каждым годом технологии производства люминесцирующих веществ совершенствуются, что помогает создавать люминофоры с улучшенными световыми качествами.
Список веществ, способных создавать свечение под тем или иным воздействием достаточно обширен, и поэтому существует несколько видов классификаций данных соединений.[2] Классификация по методу возбуждения является наиболее удобной, поэтому во многих книгах о люминофорах используют именно её.
| Способ возбуждения люминесценции | Вид люминофоров |
|---|---|
| УФ излучением | Фотолюминофор |
| Пучком электронов | Катодолюминофор |
| Электрическим полем | Электролюминофор |
| α-, β- излучением радиоактивных волн | Радиолюминофоры |
| Рентгеновским или γ- излучением | Рентгенолюминофор |
| Вид люминесценции | Вид поглощаемой энергии |
|---|---|
| Фотолюминесценция | Электромагнитное излучение (УФ, видимое) |
| Рентгенолюминесценция | Электромагнитное излучение (рентгеновское) |
| Катодолюминесценция | Кинетическая энергия электронов |
| Электролюминесценция | Энергия электрического поля |
| Радиолюминесценция | Энергия α-, β-, γ- лучей, ионов |
| Хемилюминесценция | Энергия химической реакции |
| Биолюминесценция | Энергия биохимической реакции |
| Триболюминесценция | Механическая энергия трения |
| Термолюминесценция | Тепловая энергия |
| Характер | Люминофор |
|---|---|
| Внутрицентровой | Используется непроводящий люминофор с, или люминофор с дискретными центрами |
| Рекомбинационный | Используется фотопроводящий люминофор |
Важная характеристика люминофоров — спектры поглощения, отражающие зависимость величины поглощаемой энергии от длины волны падающего на люминофор света. Спектр излучения люминофора зависит от химической природы активатора и основы люминофора, их взаимодействия, а в случае люминофоров с несколькими активаторами и от взаимодействия активаторов между собой. Спектры излучения могут зависеть от интенсивности и длины волны возбуждающего света, а также от температуры.[3]
Зависимость спектров излучения от длины волны возбуждающего света может быть хорошо прослежена на характеристических люминофорах (Ca, Mg)3(PO4)2·Sn и (Ca, Zn)3(PO4)2·Sn. Их спектры излучения состоят из широких полос, расположенных в красной и зелёной областях спектра.[3]
Количество веществ, которые можно использовать для синтеза люминофоров достаточно велико, однако на практике используются следующие классы соединений: халькогениды и фосфаты металлов второй группы, силикаты, оксиды, вольфраматы, соединения редкоземельных элементов.
Технология изготовления люминофоров относится к высокотемпературному тонкому неорганическому синтезу. Люминофоры используют в виде поликристаллических порошков, реже в виде монокристаллов и тонких плёнок. Синтез люминофоров производят при 900—1200ºС.
Для получения люминофора с заданными свойствами необходимо строго соблюдать состав шихты и условия прокаливания, не допускать попадания случайных примесей, обеспечить тщательную сушку люминофора. Также необходимо соблюдать чистоту материалов на всех этапах синтеза.[2]
- Халькогениды элементов второй группы
Почти все халькогениды представляют собой фотополупроводниковые соединения с электронным типом проводимости (примесь имеет валентность большую, чем чистый полупроводник, появляются свободные электроны). Для теллурида цинка характерна дырочная проводимость (примесь имеет меньшую валентность, чем чистый полупроводник, появляются разрывы связей — дырки), а для теллурида кадмия дырочная и электронная.[2]
Халькогенидам цинка и кадмия присуща «самоактивированная» люминесценция, обусловленная собственными дефектами, либо ассоциатами с примесью галогенов или трехвалентных катионов. Также для халькогенидов характерна люминесценция, связанная с введением активирующих примесей.[3]
Люминофоры на основе сульфидов щелочноземельных металлов синтезируют прокаливанием смесей соответствующих карбонатов с активатором, серой, плавнями и восстановителем. Основная реакция, которая протекает при синтезе люминофоров может быть представлена уравнением :
- 4MeCO3+4S→3MeS+MeSO4+4CO2{\displaystyle {\mathsf {4MeCO_{3}+4S\rightarrow 3MeS+MeSO_{4}+4CO_{2}}}}
Сульфид цинка можно получить сероводородным методом по реакции:
- ZnSO4+h3S→ZnS+h3SO4{\displaystyle {\mathsf {ZnSO_{4}+H_{2}S\rightarrow ZnS+H_{2}SO_{4}}}}
Также следует упомянуть тиосульфатный метод получения сульфидов, основанный на реакциях, которые могут быть упрощенно записаны как:
- MeSO4+2Na2S2O3→MeS2O3+Na2SO4{\displaystyle {\mathsf {MeSO_{4}+2Na_{2}S_{2}O_{3}\rightarrow MeS_{2}O_{3}+Na_{2}SO_{4}}}}
- MeS2O3+h3O→MeS+h3SO4{\displaystyle {\mathsf {MeS_{2}O_{3}+H_{2}O\rightarrow MeS+H_{2}SO_{4}}}}
При синтезе халькогенидных люминофоров исходные сульфиды получают заранее. Синтез происходит в 3 этапа:
Приготовление шихты
На технических весах взвешивают нужное количество халькогенида (порошок) и добавляют к нему заданное количество растворов плавня (вещество, добавляемое к руде при её плавке для увеличения плавкости имеющихся в ней примесей и образования шлаков) и активатора (вещество, интенсифицирующее физические и химические процессы). Шихта (исходная смесь, использующаяся в пирометаллургических или иных высокотемпературных процессах) тщательно перемешивается.
Сушка
Шихта высушивается при 100—120ºС в сушильном шкафу до пыления в течение времени зависящего от количества шихты (примерно 0,5-1 час).
Прокаливание
Прокаливание проводится в муфельной печи при заданной температуре 900—1200ºС в течение времени, зависящего от количества шихты (около 0,5-1 часа). На стадии прокаливания шихты происходит процесс образования люминофора, то есть кристаллизация основного вещества, диффузия введенных в шихту активирующих примесей, гетерогенные химические и межкристаллические реакции образования в решетке различных дефектов.[2]
Селениды цинка и кадмия получают из сульфидов по реакции, которая в упрощенном виде выглядит так:[3]
- MeS+h3SeO3→MeSe+SO2+h3O{\displaystyle {\mathsf {MeS+H_{2}SeO_{3}\rightarrow MeSe+SO_{2}+H_{2}O}}}
- Фосфаты металлов второй группы
Среди фосфатов наиболее широкое применение в производстве люминофоров находит фосфат кальция, который используется для люминесцентных источников света. Разнообразие люминесцентных свойств фосфатов заключается в наличии у них большого количества полиморфных модификаций, относительной рыхлостью решеток, которые создают благоприятные условия для формирования люминофора. Также для синтеза люминофоров используют фосфат цинка, который является основой для синтеза катодолюминофоров с красным излучением. Двойные фосфаты кальция и магния используют для синтеза люминофоров, которые впоследствии применяют в лампах ультрафиолетового излучения.[2]
Фосфаты в твердой фазе можно синтезировать по-разному. Например, фосфаты кальция и стронция получаются по одному из следующих вариантов:[3]
- Me2P2O7+MeCO3→1000∘CMe(PO4)2+CO2{\displaystyle {\mathsf {Me_{2}P_{2}O_{7}+MeCO_{3}{\xrightarrow {1000^{\circ }C}}Me(PO_{4})_{2}+CO_{2}}}}
- 3MeCO3+2(Nh5)2HPO4→1100∘CMe3(PO4)2+4Nh4+3CO2+2h3O{\displaystyle {\mathsf {3MeCO_{3}+2(NH_{4})_{2}HPO_{4}{\xrightarrow {1100^{\circ }C}}Me_{3}(PO_{4})_{2}+4NH_{3}+3CO_{2}+2H_{2}O}}}
- Силикаты
Самое большое распространение в производстве силикатных люминофоров получил силикат цинка, использующийся как основа для катодолюминофоров с зелёным свечением. Благодаря высокой химической и термической стойкости, стабильности к электронной бомбардировке, силикатные люминофоры используются в электронно-лучевых приборах.[2] Силикат цинка готовят прокаливанием смеси ZnO c SiO2 при 1200º.[3]
Силикат кальция, активированный Pb и Mn может быть получен путем прокаливания смеси карбонатов или окислов соответствующих металлов с SiO2. Для этого требуется температура в 1150º и атмосфера водяного пара, который оказывает минерализующее действие (превращение в твердое состояние).[3]
- Оксидные системы
Многие металлы II, III, IV групп периодической системы обладают люминесценцией при фото-, катодном и рентгеновском возбуждении, но практическое применение имеют немногие. Наиболее широкое применение получил оксид цинка, использующийся в качестве катодолюминофора с очень коротким послесвечением, а также в низковольтных катодолюминофорных индикаторах.
В качестве основы для синтеза катодолюминофоров всё более широкое применение имеют оксиды и оксисульфиды редкоземельных элементов (РЗЭ). Их существенным преимуществом является большая насыщенность цвета и высокая стабильность к электронной бомбардировке.[2]
- Вольфраматы
Вольфраматные люминофоры в основном относятся к самоактиворованным, то есть люминесцируют без введения активатора.[2]
- Соединения редкоземельных элементов
Соединения РЗЭ успешно играют роль, как основного вещества, так и активатора. Такие соединения используются в синтезе катодолюминофоров, работающих при высоких плотностях тока электронного возбуждения.[2]
Использование люминофоров в технике позволяет нам экономить на электроэнергии, так как развитие полупроводниковой техники стимулировало работы по созданию инжекционных электролюминесцентных источников освещения. Возможность смотреть телевизор предоставляется благодаря люминофорам, ведь для экранов приемных телевизионных трубок практикуется использование смесей люминофоров для получения высокой яркости свечения близкого к белому. Применение люминофоров в медицинской отрасли позволяет делать рентген и флюорографию. А также способность люминофоров светиться без электрического источника энергии нашла применение в системах эвакуации и пожарной безопасности.
Неорганические люминофоры применяют в люминесцентных лампах, электронно-лучевых трубках, для изготовления рентгеновских экранов, служат индикаторами радиации и др.
Органические люминофоры (иногда их называют «люмогены») применяют для изготовления ярких флуоресцентных красок для окрашивания текстиля, пластмасс, украшений, в типографских красках, для пигментации полимерной глины, красок для обоев, пигментов для татуировки, косметики, люминесцирующих материалов, используют для выявления трещин в деталях, чувствительном люминесцентном анализе в химии, биологии, медицине и криминалистике.
- ↑ Волков В.А., Вонский Е.В., Кузнецова Г.И. Выдающиеся химики мира. — Москва, 1991.
- ↑ 1 2 3 4 5 6 7 8 9 10 Гурецкая З.И. Технология люминофоров и люминесцентных экранов. — Москва, 2005.
- ↑ 1 2 3 4 5 6 7 Казанкин О.Ф., Марковский Л.Я., Миронов И.А., Пекерман Ф.М., Пето-шина Л.Н. Неорганические люминофоры. — Ленинград, 1975.
- Жиров Н. Ф. Люминофоры. — М.: Гос. изд-во оборонной пром-ти, 1940. — 480 с.
